熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
討論:
目前的研究表明,神經(jīng)炎癥、谷氨酸轉(zhuǎn)運體和受體的表達及功能變化參與了嗎啡耐受性的形成。具體而言,在嗎啡耐受動物的脊髓背角發(fā)現(xiàn)促炎細胞因子(TNF-α、IL-1β、IL-6)釋放、星形膠質(zhì)細胞活化、GLT-1、GS硝化和NMDA受體NR2B亞基的販運明顯增加。腹腔注射HS能顯著減輕嗎啡對甩尾潛伏期、脈搏波速度和脈搏波速度的影響,且呈劑量依賴性。同時,HS能減少炎性細胞因子的釋放,抑制GLT-1和GS的硝化,降低谷氨酸濃度的升高,減少NR1和NR2B的總表達和膜轉(zhuǎn)運。上述數(shù)據(jù)表明,HS可能是緩解嗎啡耐受性發(fā)展的一種潛在治療方法。
很少有研究報告稱重復(fù)注射嗎啡與耐受性有關(guān)。彈尾潛伏期或熱板試驗和VonFrey試驗是測試動物對熱和機械刺激敏感性的最常用方法。在本研究中,尾彈潛伏期、PWT和PWL的降低表明嗎啡耐受大鼠模型已成功建立。我們的數(shù)據(jù)顯示,嗎啡在第1天產(chǎn)生了顯著的抗痛覺作用,并在第5天誘導(dǎo)了耐受。注射HS能以劑量依賴性的方式增加慢性嗎啡給藥引起的尾彈潛伏期、脈搏波速度和脈搏波速度的降低。有研究認為HS可抑制嗎啡重復(fù)給藥引起的抗痛作用的降低。對于正常組,即使最大劑量的氫氣對行為試驗沒有影響,氫氣對病理狀態(tài)也有治療作用,但對正常生理狀態(tài)沒有影響。
脊髓小膠質(zhì)細胞的激活與神經(jīng)病理性疼痛的發(fā)病機制密切相關(guān)。在我們的研究中,觀察到重復(fù)嗎啡給藥導(dǎo)致的TNF-α、IL-1β和IL-6蛋白增強,這與之前的研究結(jié)果一致。此外,脊髓GFAP表達明顯增加,表明反復(fù)鞘內(nèi)注射嗎啡增加了星形膠質(zhì)細胞的活化。慢性嗎啡誘導(dǎo)的神經(jīng)膠質(zhì)細胞活化機制尚不十分清楚,研究發(fā)現(xiàn)可能與鞘氨醇-1-磷酸(S1P)受體系統(tǒng)有關(guān)。S1P受體1的激活可通過NADPH氧化酶誘導(dǎo)超氧化物,當(dāng)與一氧化氮結(jié)合時會導(dǎo)致一系列事件,最終導(dǎo)致星形膠質(zhì)細胞/小膠質(zhì)細胞活化,促炎細胞因子的產(chǎn)生增加。在我們的研究中,聯(lián)合使用氫氣可顯著降低脊髓TNF-α、IL-1β、IL-6和GFAP的表達,這表明氫氣可有效抑制神經(jīng)炎癥。然后測量動脈和靜脈中的氫濃度。注射HS后,氫氣濃度隨時間逐漸升高,在15分鐘內(nèi)達到峰值,然后逐漸降低。同時,動脈血中的氫濃度高于靜脈血中的氫濃度,這表明氫部分進入了細胞,起到了抗炎和抗氧化的作用。這是首次有研究表明腹腔注射HS可以減輕慢性嗎啡引起的神經(jīng)炎癥,但其潛在機制還需要進一步研究。
星形膠質(zhì)細胞上表達的GLT-1被認為負責(zé)清除突觸前膜釋放的90%以上的谷氨酸,將谷氨酸轉(zhuǎn)運到星形膠質(zhì)細胞,然后通過GS將興奮性谷氨酸轉(zhuǎn)化為谷氨酰胺。本研究發(fā)現(xiàn),與N組相比,M組脊髓中GLT-1、GS的硝化程度和谷氨酸濃度均有所增加。這證實了長期服用嗎啡可改變星形膠質(zhì)細胞谷氨酸轉(zhuǎn)運體的功能,導(dǎo)致谷氨酸平衡失調(diào),增加興奮毒性。GS酪氨酸殘基的硝化導(dǎo)致GS活性失活,降低了谷氨酸轉(zhuǎn)化為無毒谷氨酰胺的能力,增加了神經(jīng)毒性。與M組相比,M+HS組GLT-1和GS硝化程度及谷氨酸濃度均有所降低,表明在嗎啡耐受性大鼠模型中腹腔注射HS可抑制GLT-1和GS硝化,提高星形膠質(zhì)細胞從突觸間隙吸收谷氨酸的能力,減輕神經(jīng)毒性。與M組相比,GLT-1激動劑緩解了嗎啡耐受性,而GLT-1抑制劑不能緩解嗎啡反復(fù)注射引起的鎮(zhèn)痛能力下降,同時給予GLT-1和氫氣,也沒有進一步緩解嗎啡耐受性的發(fā)展,說明氫氣通過改善GLT-1的功能抑制嗎啡耐受性的形成。該研究首次證實氫氣能有效抑制GLT-1和GS的功能,為今后治療和預(yù)防嗎啡耐受提供了有效途徑。
研究證實,NMDA受體在谷氨酸能受體系統(tǒng)中非常重要,與突觸可塑性和慢性疼痛的形成密切相關(guān)。最近發(fā)表的一篇文章顯示,NO/NMDA受體對嗎啡慢性治療的抗驚厥作用有介導(dǎo)作用,從而導(dǎo)致小鼠模型對嗎啡鎮(zhèn)痛作用的耐受性。在本研究中,與N組和V組相比,M組tNR1、mNR1、tNR2B、mNR2B的表達量和m/tNR1orm/tNR2B的比值均有所增加,表明含有NR2B亞基的NMDA受體表達量增加和膜販運參與了嗎啡耐受。與M組相比,腹腔注射HS可抑制總表達和MSNR1和NR2B的膜運輸,但對NR1和NR2B在未注射嗎啡的正常大鼠中表達。同時服用選擇性NR2B拮抗劑可部分緩解嗎啡耐受性的發(fā)展,而同時服用NR2B抑制劑和HS并不能進一步緩解嗎啡耐受性的發(fā)展,這表明HS通過抑制NMDA受體的功能來抑制嗎啡耐受性的形成。長期服用嗎啡誘導(dǎo)NMDA受體表達和遷移的內(nèi)在機制尚不完全清楚,可能與GLT-1和GS功能受損,導(dǎo)致谷氨酸濃度增加和NMDA受體異常激活有關(guān)。
上述數(shù)據(jù)表明,通過調(diào)節(jié)NMDA受體的功能,HS可以成為減輕嗎啡耐受性的一種潛在治療策略。
結(jié)論:
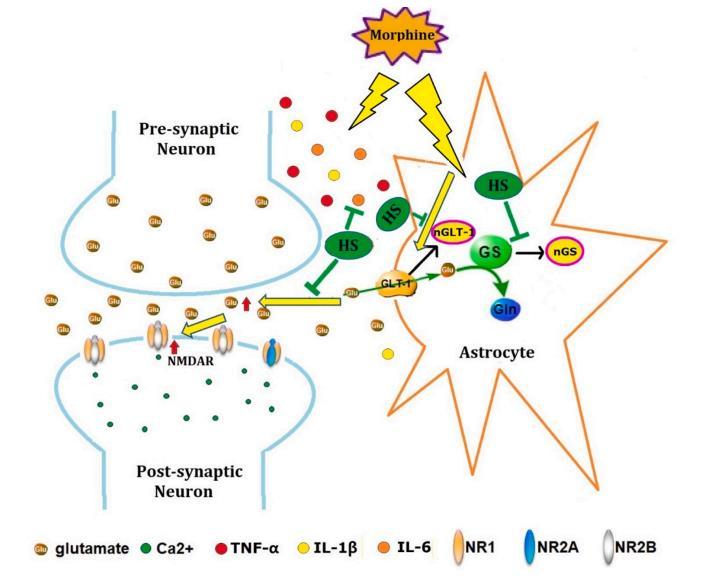
圖7:HS預(yù)處理可抑制嗎啡反復(fù)給藥后神經(jīng)炎癥、GLT-1、GS硝化和NMDA受體轉(zhuǎn)運及功能增加。
綜上所述,本研究表明,反復(fù)鞘內(nèi)注射嗎啡(每次10μg/10μL,每天兩次,共5天)可增加TNF-α和IL-1β等炎癥因子的水平,釋放IL-6,并激活脊髓背側(cè)角的星形膠質(zhì)細胞。一方面,氫氣可增加炎癥因子如TNF-α和IL-1β的水平,釋放IL-6,激活脊髓背角的星形膠質(zhì)細胞;另一方面,氫氣可引起GLT-1和GS的硝化,增加突觸間隙中谷氨酸的濃度,促進含有NR2B亞基的NMDA受體的膜遷移,導(dǎo)致嗎啡耐受(圖7)。因此,氫氣預(yù)處理以劑量依賴的方式部分逆轉(zhuǎn)了甩尾潛伏期、PWT和PWL的下降,降低了TNF-α、IL-1β和IL-6的表達、GLT-1、GS的硝化以及膜和總NR1、NR2B的表達,表明氫氣通過減少神經(jīng)炎癥、GLT-1和GS的硝化、NMDA受體在脊髓背角的遷移和功能,阻止了嗎啡耐受性的形成。氫氣預(yù)處理可被視為預(yù)防嗎啡耐受性的一種新型治療策略。
嗎啡的反復(fù)鞘內(nèi)給藥一方面增加了TNF-α和IL-1β等炎癥因子的水平和IL-6的釋放,激活了脊髓背角的星形膠質(zhì)細胞,另一方面導(dǎo)致了GLT-1和GS的硝酸化表達,增加了突觸間隙中谷氨酸的濃度,促進了含有NR2B亞基的NMDA受體的膜販運,導(dǎo)致了中樞敏化和嗎啡耐受。HS預(yù)處理可減少炎癥細胞因子的增加,抑制GLT-1和GS的硝化表達,減少NMDA受體的膜販運。因此,HS可能為預(yù)防嗎啡耐受提供了可能。
氫氣電極研究硫化氫預(yù)處理、注射富氫鹽水能否抑制嗎啡耐受性形成(一)
 相關(guān)新聞
相關(guān)新聞