熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
結果:
1.富氫生理鹽水(HS)預處理對嗎啡耐受抑制作用成劑量依賴性
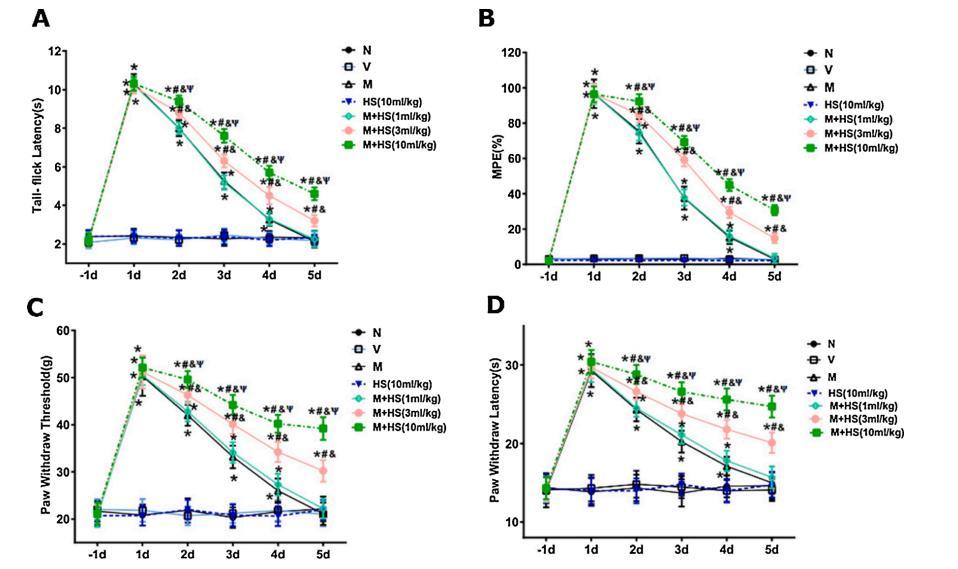
圖1:HS預處理對嗎啡耐受的抑制呈劑量依賴性
如圖1所示,不同組的基線甩尾潛伏期(A)、MPE(%)(B)、脈搏波速度(C)和脈搏波速度(PWL)(D)均無明顯差異(P>0.05)。與N組相比,V組和HS組的甩尾潛伏期、脈搏波速度和脈搏波速度無明顯差異,但M組在第1、2、3和4天顯著增加(P<0.01)。嗎啡與HS(3和10mL/kg)聯合給藥部分逆轉了嗎啡注射引起的甩尾潛伏期(A)、MPE(%)(B)、PWT(C)和PWL(D)的下降(p<0.01)。然而,在沒有嗎啡的情況下,即使最大劑量的HS(10mL/kg)也沒有對疼痛行為測試產生影響(圖1)(與N組相比,p>0.05)。
在注射嗎啡前10分鐘,以1、3和10mL/kg的劑量腹腔注射HS。在基線(-1d)和長達5天的每日評估中。
2.注射HS后動脈和靜脈中氫濃度的時間過程
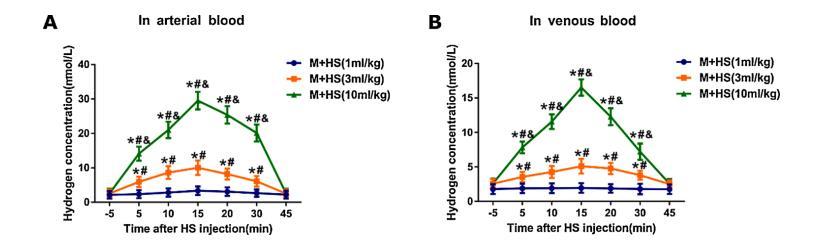
圖2:注射HS后動脈血、靜脈血氫濃度的變化
在不同時間點檢測動脈血和靜脈血中的氫濃度。數據顯示(圖2),注射富氫鹽水HS后,動脈血和靜脈血中的氫氣濃度分別在5分鐘、15分鐘和45分鐘達到峰值(p<0.01)。與M+HS(1mL/kg)組相比,M+HS(3mL/kg)組和M+HS(10mL/kg)組血液中溶解的氫濃度更高。與M+HS(3mL/kg)組相比,M+HS(10mL/kg)組的氫濃度顯著增加。
在每次注射嗎啡前10分鐘腹腔注射濃度為1、3和10mL/kg的HS。動脈血(A)和靜脈血(B)中的氫濃度(μmol/L)分別在基線(-5分鐘)和注射HS后5、10、15、20、30和45分鐘進行測量。數據以平均值±SD表示(n=8)。
3.HS預處理可抑制嗎啡耐受大鼠脊髓中促炎細胞因子的釋放和星形膠質細胞的活化
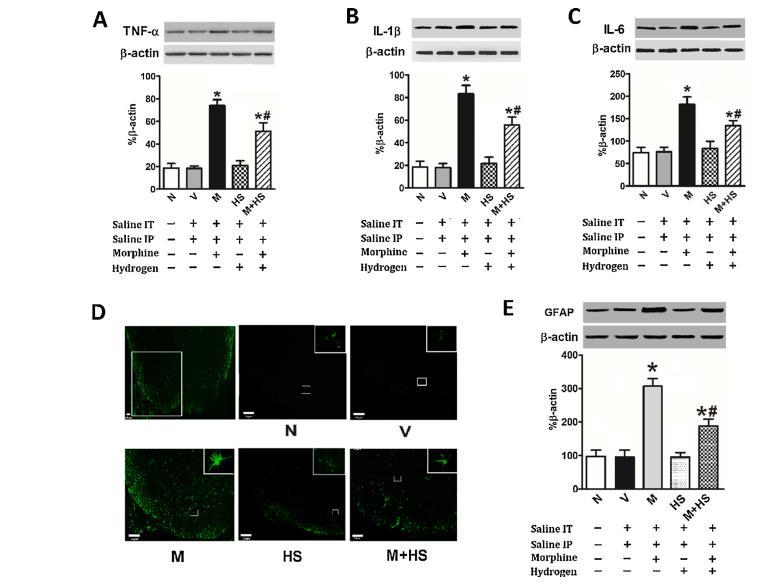
圖3:HS預處理可抑制嗎啡耐受大鼠脊髓中TNF-α、IL-1β、IL-6表達升高及星形膠質細胞活化
如圖3所示,M組TNF-α(A)、IL-1β(B)和IL-6(C)的表達明顯增加(p<0.01)。HS預處理明顯降低了嗎啡誘導的TNF-α、IL-1β和IL-6的增強(p<0.01)。
為了檢測星形膠質細胞的活化情況,對特異性星形膠質細胞標記物GFAP進行了免疫熒光和Western印跡檢測。如圖3D和E所示,反復鞘內注射嗎啡顯著增加了星形膠質細胞的活化,主要分布在背角淺層(薄層I-III)(圖3D)。與M組相比,聯合注射HS明顯降低了星形膠質細胞的活化(p<0.01)。然而,在沒有注射嗎啡的情況下,即使最大劑量的HS(10mL/kg)也沒有對促炎細胞因子的釋放和星形膠質細胞的活化產生影響(圖3),(p>0.05)。
采用Western印跡和免疫熒光染色檢測促炎細胞因子和GFAP的表達水平。β-肌動蛋白作為內部對照。Western印跡法檢測TNF-α(A)、IL-1β(B)、IL-6(C)和GFAP(E)的條帶,并觀察TNF-α/β-肌動蛋白、IL-1β/β-肌動蛋白、IL-6/β-肌動蛋白和GFAP/β-actin的比例條形圖。(D)用免疫熒光評估GFAP在L4-6脊髓中的表達。數據以平均值±SD表示(n=8)。
4.腹腔注射HS可降低嗎啡耐受模型中的GLT-1、GS硝化和谷氨酸濃度
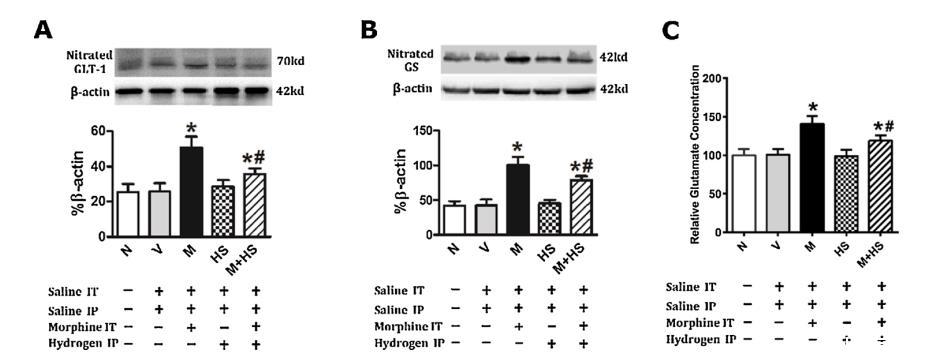
圖4:HS預處理可抑制慢性嗎啡誘導的脊髓GLT-1增強、GS硝化和谷氨酸濃度升高
如圖4所示,與N組相比,嗎啡給藥5天導致脊髓GLT-1(A)、GS硝化(B)和谷氨酸濃度顯著增加(P<0.01)。N組和V組之間沒有差異(P>0.05)。與M組相比,預處理HS可降低GLT-1、GS硝化和谷氨酸的濃度(P<0.01)。然而,即使是最大劑量的HS(10mL/kg),在沒有嗎啡的情況下,GLT-1、GS硝化和谷氨酸濃度的表達也沒有變化(p>0.05)。
采用免疫沉淀和Western印跡技術研究GLT-1和GS硝化的變化。β-肌動蛋白作為內部對照。圖中顯示了Western印跡中硝化的GLT-1(A)和硝化的GS(B)蛋白條帶,以及硝化的GLT-1/β-肌動蛋白和硝化的GS/β-肌動蛋白的比率條形圖。N組的谷氨酸濃度值為100%(C)。數據以均數±SD表示(n=8)。
5.HS預處理降低了NR1和NR2B亞基的表達,并抑制了嗎啡誘導的NMDA受體反復遷移。
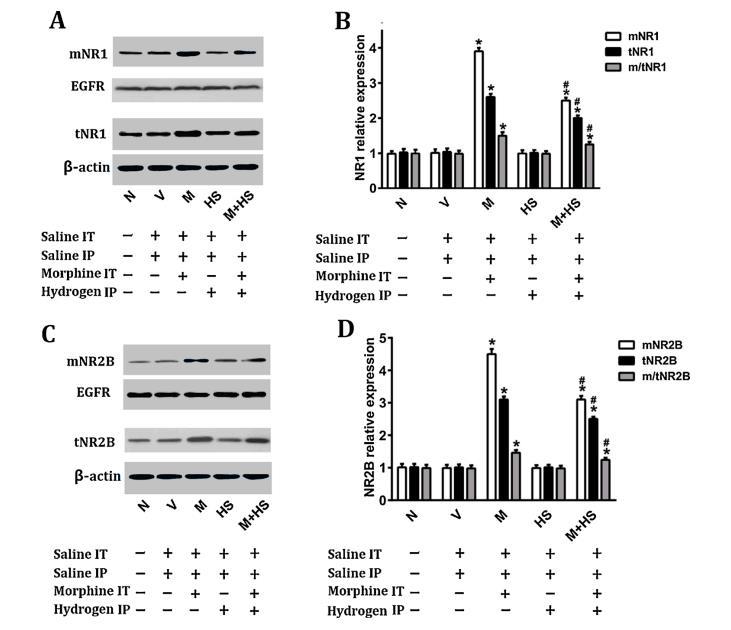
圖5:HS預處理可抑制嗎啡耐受大鼠脊髓NR1和NR2B膜的轉運
如圖5所示,鞘內給藥嗎啡誘導mNR1、tNR1、m/tNR1(A,B)和m/tNR1的比值增強mNR2B、tNR2B和m/tNR2B(C,D)(p<0.01),而HS處理部分降低水平(p<0.01)。這些結果表明,氫氣預處理可通過減少NR1和NR2B的表達以及抑制NMDA受體的販運來防止嗎啡耐受性的產生。
最后一次行為測試后收集脊髓L4-6節段。表皮生長因子受體(EGFR)和β-肌動蛋白(β-actin)作為內部對照。N組的條帶強度值為1。(A,C)通過Western印跡觀察膜蛋白和總NR1及NR2B蛋白的條帶。(B)mNR1/EGFR、tNR1/β-actin和m/tNR1的比率柱狀圖。(D)mNR2B/EGFR、tNR2B/β-actin和m/tNR2B的比率直方圖。所有數據均以均數±SD表示(n=8)。
6.抑制GLT-1轉運體可防止富氫生理鹽水(HS)阻斷嗎啡耐受性
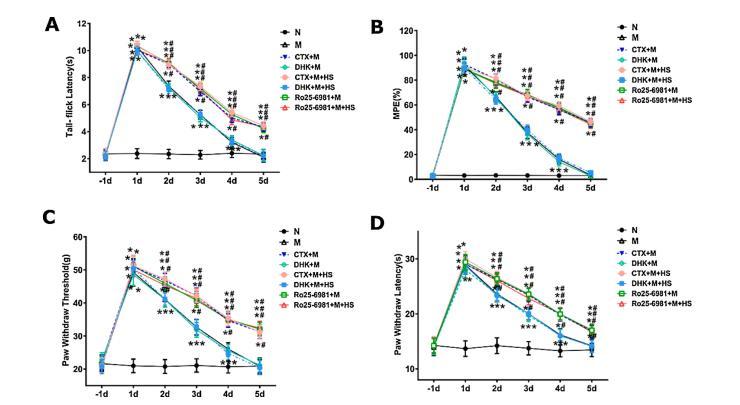
圖6:GLT-1轉運體抑制可阻止富氫鹽水(HS)阻斷嗎啡耐受
如圖6所示,不同組間基線甩尾潛伏期(A)、MPE(%)(B)、PWT(C)和PWL(D)無顯著差異(P>0.05)。與N組相比,M組、DHK+M組、DHK+M+HS組(d1~4)的TFL、PWT和PWL顯著增加(P<0.01),CTX+M組、CTX+M+HS組、Ro25-6981+M組、Ro25-6981+M+HS組(d1~5)的TFL、PWT和PWL顯著增加(P<0.01)。CTX(200mg/kg,靜注)與嗎啡聯合給藥部分逆轉了嗎啡注射引起的甩尾潛伏期(A)、MPE(%)(B)、PWT(C)和PWL(D)的下降(p<0.01)。然而,與CTX+M相比,CTX+M+HS的TFL、PWT和PWL沒有顯著變化。聯合給藥DHK(10毫克/千克,靜脈注射)和HS對嗎啡耐受性沒有影響。選擇性NR2B拮抗劑RO25-6981與嗎啡聯合給藥部分逆轉了嗎啡注射誘導的尾閃潛伏期(A)、MPE(%)(B)、PWT(C)和PWL(D)的下降(p<0.01)。與RO25-6981+M相比,HS沒有進一步緩解重復注射嗎啡引起的TFL、PWT和PWL的下降。
在基線(-1d)和長達5天的每日基礎上評估彈尾潛伏期(A)、MPE(%)(B)、脈搏波速度(C)和脈搏波速度(D)。數據以均數±標碼表示(n=6)。
氫氣電極研究硫化氫預處理、注射富氫鹽水能否抑制嗎啡耐受性形成(一)
 相關新聞
相關新聞