熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
2.4.電生理記錄與分析
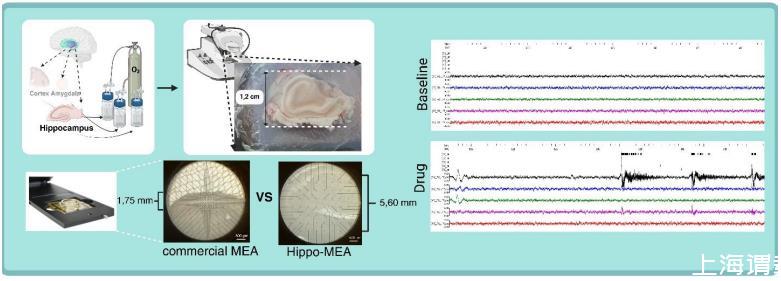
基本的MEA記錄方案和記錄溶液如前所述。Hippo-MEA的數(shù)據(jù)使用MEA2100-Mini-system記錄。使用EP2 Ag/AgCl顆粒作為參考電極。實驗在持續(xù)灌注記錄溶液(3 ml/min,32-34°C,溶液用95%O?/5%CO?氣體充氧)的條件下進行,切片用HSG-MEA-5AD錨定器固定。記錄前讓切片在MEA上穩(wěn)定30分鐘。實際記錄包括10分鐘基線期、10分鐘4-氨基吡啶(4-AP;1 mM)處理期和10分鐘沖洗期。
細(xì)胞外動作電位(EAP)和局部場電位(LFP)數(shù)據(jù)的分析基于先前描述的NeuroExplorer流程。簡而言之,EAPs從帶通濾波信號(300-3000 Hz,二階巴特沃斯濾波器)中檢測,當(dāng)其振幅超過噪聲標(biāo)準(zhǔn)偏差(SD)的-5.5倍時被判定為EAP。在4-AP峰值效應(yīng)期間(970秒至1270秒)的任何10秒?yún)^(qū)間內(nèi)達到活性電極標(biāo)準(zhǔn)(最少兩個EAPs,平均頻率0.05 Hz,瞬時頻率0.1 Hz)的電極被認(rèn)為顯示出真實的EAP活動。LFP數(shù)據(jù)從低通濾波信號(<200 Hz,二階巴特沃斯濾波器)中提取,分析五個頻帶:delta(δ)1-3 Hz,theta(θ)4-8 Hz,alpha(α)9-13 Hz,beta(β)14-30 Hz和gamma(γ)30-100 Hz。使用閾值法識別對LFP數(shù)據(jù)每個頻率范圍有反應(yīng)的電極。計算每個電極和頻率范圍在基線期(0秒至600秒)的功率譜密度(PSD)平均值,以此確定基線噪聲。如果在4-AP期間(670秒至1270秒)的任何10秒?yún)^(qū)間的PSD超過基線噪聲SD的5.5倍,則該電極被視為有反應(yīng)。
2.5.免疫組織化學(xué)
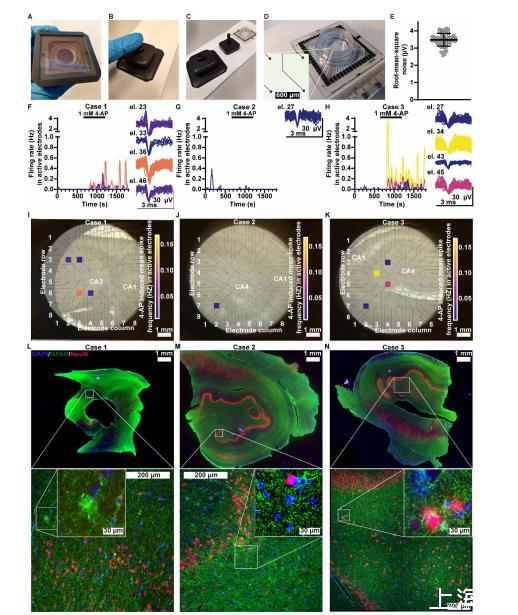
為確保染色用的冰凍切片完整,冠狀免疫組織化學(xué)(IHC)切片厚度為990μm,病例1除外(僅有300μm切片)。IHC切片與Hippo-MEA切片在組織中的頭尾距離為:病例1相距300μm,病例2相距1500μm,病例3相距0μm。樣本經(jīng)過固定、冷凍保護、冷凍切片成20μm厚切片,并用先前描述的方法染色。使用的一抗包括:用于神經(jīng)元可視化的NeuN(1:200稀釋)和用于星形膠質(zhì)細(xì)胞染色的GFAP(1:750稀釋)。使用Alexa Fluor 488(1:300稀釋)和Alexa Fluor 568(1:300稀釋)作為二抗。圖像使用Leica Thunder Imager 3D組織切片掃描儀獲取。
3.結(jié)果與討論
3.1.Hippo-MEA的特性
Hippo-MEA中電極的阻抗為35±5 kΩ(平均值±SD),低于先前用相同方法制備的電極所報告的值(83±5 kΩ)。雖然較低的阻抗通常是更好信號檢測的標(biāo)志,但此處測量的值是由于更大的電極直徑(60μm對30μm)。在基線記錄期間,RMS噪聲為3.4±0.5μV(圖1E),這與先前用相同方法制備的電極相似。安裝工具使得樣品杯和Hippo-MEA的組裝變得容易(圖1A-D)。硅膠器件附著到玻璃狀MEA表面可能需要例如等離子體處理,但在此超過10個月的時間內(nèi)未觀察到粘合問題。
3.2.Hippo-MEA上的EAP活性與病理結(jié)構(gòu)特征
用Hippo-MEA分析的樣本對4-AP處理表現(xiàn)出不同的EAP活性(圖1F-K)。病例1有4/59個活性電極(檢測到EAPs的電極;圖1F),病例2有1/59(圖1G),病例3有4/59(圖1H)。在峰值藥物效應(yīng)期間(970秒至1270秒),活性電極的平均放電頻率在病例1為0.046 Hz,病例2為0.010 Hz,病例3為0.067 Hz。在單個電極中,放電頻率可瞬間高達3.333 Hz(圖1H)。
活性電極的定位(圖1 I-K)與錐體細(xì)胞層(圖1 L-N)不符,這與觀察到的錐體細(xì)胞層中NeuN陽性細(xì)胞(神經(jīng)元)的丟失以及病理學(xué)家對海馬硬化的評估一致(表1,組織病理學(xué))。相反,活性電極的位置更對應(yīng)于齒狀回的顆粒細(xì)胞層,那里有明顯的NeuN陽性神經(jīng)元(圖1I對L,J對M和K對N)。除了硬化,海馬膠質(zhì)細(xì)胞增生是TLE的典型病理特征。所有三個海馬體中對星形膠質(zhì)細(xì)胞蛋白GFAP的染色均顯示出廣泛的膠質(zhì)增生(圖1L-N),這可能導(dǎo)致切片大部分區(qū)域未顯示EAPs(圖1I-K)。活性水平也可能受到長時間恢復(fù)期的影響(見樣本運輸與制備)。總體而言,結(jié)果表明Hippo-MEA能夠識別活性和非活性區(qū)域,并能從硬化的人類海馬體切片中檢測到EAPs。
3.3.Hippo-MEA上的LFPs
與EAP活性類似,Hippo-MEA上的LFP活性在患者之間也存在差異。代表性的LFP軌跡顯示在圖2A和B(包含患者3的EAP點陣圖)。響應(yīng)電極數(shù)量最多的頻帶是delta頻帶(平均9/59),而響應(yīng)電極數(shù)量最少的頻帶是alpha頻帶(平均2/59)(圖2C)。對gamma頻帶響應(yīng)的電極數(shù)量是可變的(從2/59到11/59)。腦電圖數(shù)據(jù)中delta頻帶功率的增加是TLE患者癲癇活動的一個標(biāo)志。因此,有趣的是,4-AP(一種已知的驚厥劑)尤其增加了delta頻帶功率,即使在病例2中也是如此,而病例2在其他方面比其他病例活性低。
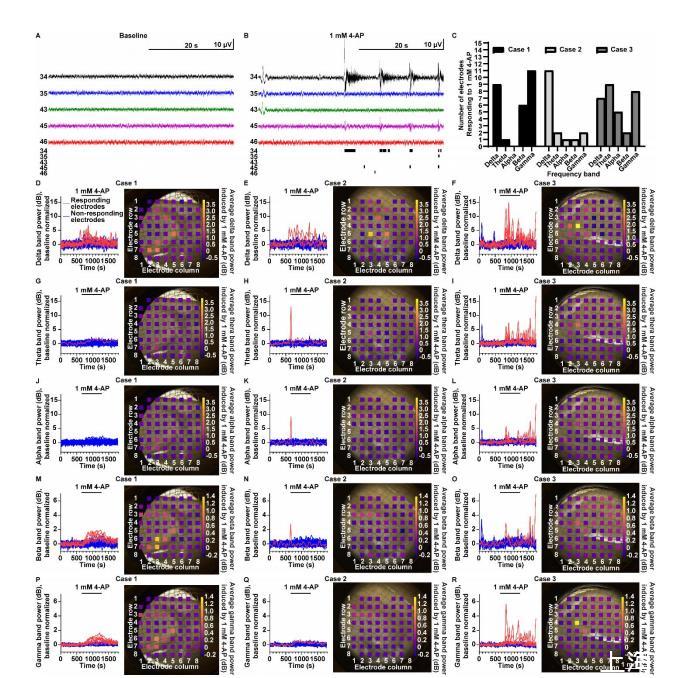
隨時間變化的歸一化LFP頻帶功率顯示在圖2D-R(左側(cè)),同一子圖中顯示了4-AP處理期間整個切片的平均頻帶功率增加(右側(cè))。同樣,對4-AP刺激反應(yīng)最強烈的電極并非位于錐體細(xì)胞層附近,這一特征可能與錐體神經(jīng)元的硬化有關(guān)(圖2D-R對比圖1L-N;表1)。相反,顯示4-AP誘導(dǎo)LFP活性增加的電極更靠近齒狀回的顆粒細(xì)胞層。結(jié)果表明,Hippo-MEA能夠檢測硬化人類海馬體切片中的LFP活性,并能區(qū)分樣本中的活性和非活性位點。
4.結(jié)論
Hippo-MEA和樣品杯的尺寸適合記錄大樣本(如海馬體切片)。Hippo-MEA能夠同時記錄來自海馬體不同亞區(qū)的EAP和LFP數(shù)據(jù)。雖然該記錄系統(tǒng)只允許59個記錄電極,限制了陣列的空間分辨率,但該記錄系統(tǒng)是商業(yè)化的,并且允許使用現(xiàn)有的軟件,使得Hippo-MEA易于被采用。通過與其他方法的數(shù)據(jù)進行比較,Hippo-MEA可以為改進TLE手術(shù)中最佳切除區(qū)域的識別提供一個起點,并有助于理解海馬體病理對TLE的貢獻。
 相關(guān)新聞
相關(guān)新聞