熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
姜黃素在體內的抗血管生成作用
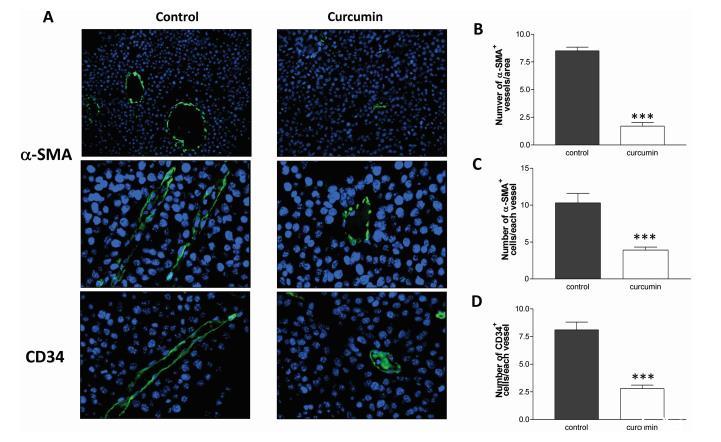
據報道,姜黃素在體外和體內都有抗血管生成的作用。因此,我們使用針對內皮細胞標記物α-平滑肌肌動蛋白(α-SMA)和CD34抗原(CD34)的抗體,分析了小鼠使用姜黃素或單獨使用載體處理B16異種移植后的血管數量和大小。如圖3所示,姜黃素顯著減少了單位面積的α-SMA陽性血管數量(圖3A和B)以及單位血管的α-SMA和CD34陽性細胞數量(圖3A-D),這表明系統給藥的多酚對B16異種移植具有抗血管生成活性。
姜黃素通過促進氧化應激和脂質應激,降低不同癌細胞株的活力并誘導腫瘤細胞凋亡
姜黃素的抗代謝作用有望轉化為細胞生長的減少。因此,我們分析了多酚處理后腫瘤細胞的存活率。我們觀察到,用10μM姜黃素處理24小時后,B16、CT26、L1210和4T1細胞活力顯著降低,分別降低了37%、28%、20%和36%(圖4A)。
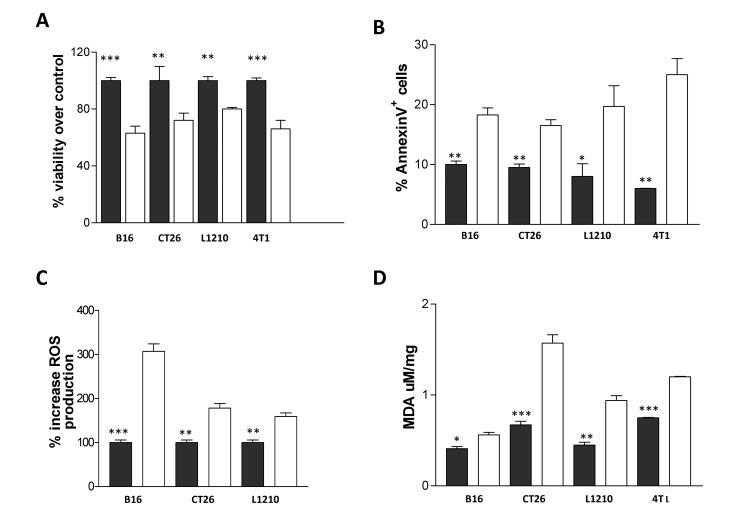
姜黃素處理B16、CT26、L1210和4T1細胞24小時后,細胞凋亡率增加,分別比對照組細胞增加了83%、73%、146%和316%(圖4B)。
姜黃素處理過的B16、CT26和L1210細胞中的ROS分別比對照組高出207%、59%和78%(圖4C),細胞凋亡可能是姜黃素誘導ROS的結果。同樣,姜黃素處理的細胞中,脂質過氧化標志物丙二醛(MDA)水平比對照組細胞增加(B16、CT26、L1210和4T1細胞分別增加了37%、134、109和60%圖4D)。
姜黃素激活AMPK,誘導自噬
5'-AMP激活的蛋白激酶(AMPK)是細胞中的一個主要能量檢查點,我們預測姜黃素處理的細胞中ATP/AMP比率的改變會激活AMPK。但我們觀察到姜黃素處理的B16細胞與對照組相比,AMPK磷酸化有很強的誘導作用,使用抗磷酸AMPK(pAMPK-Thr172)抗體進行的Western印跡顯示了這一點(180%;圖5A)。
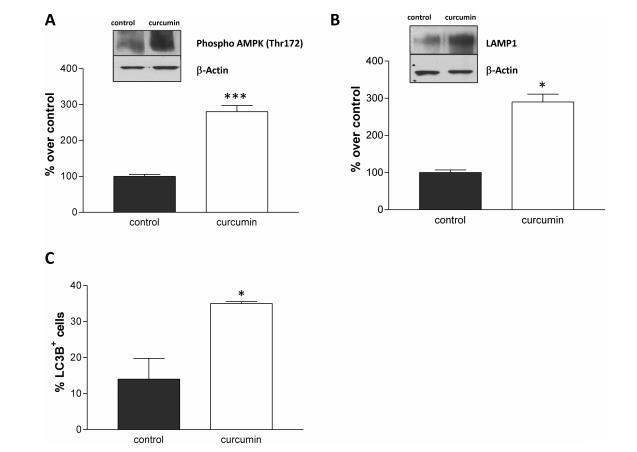
為了重建足夠的ATP水平,pAMPK誘導自噬。我們測量了作為自噬標志物的微管相關蛋白1輕鏈3β(LC3B)和溶酶體相關膜蛋白1(LAMP1)。與對照組相比,姜黃素處理的B16細胞中這兩種蛋白都有明顯誘導作用(LAMP1和LC3B的誘導作用分別為190%和150%,圖5B和C)。
姜黃素改變糖酵解酶的活性
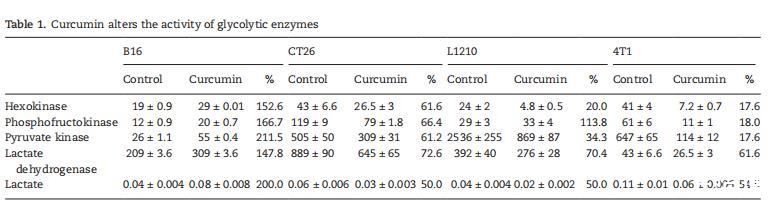
通過氧化磷酸化減少的ATP合成可以通過增強糖酵解活性來補償,雖然效率較低,但也能產生ATP。對己糖激酶(HK)、磷酸果糖激酶(PFK)、丙酮酸激酶(PK)、乳酸脫氫酶(LDH)等關鍵糖酵解酶活性和乳酸水平的分析表明,CT26、L1210和4T1細胞的情況并非如此,后者的酶活性也降低或保持不變(表)。結果表明所有四種酶活性的誘導以及乳酸生成表明對ATP合酶抑制的部分補償作用(表)。
討論
姜黃素的抗腫瘤活性在各種模型中得到了很好的證實,主要與姜黃素對腫瘤炎癥的作用有關,這種作用既作用于微環境,也作用于癌細胞本身。這些抗炎作用的主要介質是NFκB,它是炎癥和細胞凋亡的主要調節因子。許多其他信號通路被描述為受姜黃素的影響,但尚不清楚這些通路在多大程度上是姜黃素的主要分子靶點。
越來越多的證據表明姜黃素的抗糖尿病作用及其對細胞代謝的影響激發了我們對其對腫瘤代謝的潛在活性的興趣。最近的研究表明,對能量高度活躍的腫瘤細胞的營養供應的限制可以極大地改變腫瘤代謝,從而改變腫瘤細胞的活力和生長。最近有人假設姜黃素可以作為卡路里限制的模擬物。
因此,我們研究了姜黃素對腫瘤細胞代謝的影響,重點是ATP合成,因為多酚已被證明通過結合復合物F1片段的特定位點來抑制來自大腸桿菌的ATP合成酶,從而顯著增加ATP水解的催化停留時間。在正常大鼠肝細胞中,姜黃素對線粒體ATP合成酶的影響已經有報道,姜黃素作為質子載體解偶聯劑,從而激活該復合物的fof1-ATP酶活性,導致ATP生物合成減少。因此,AMP水平的增加被認為是激活主能量傳感器AMPK的原因。在這里,我們發現姜黃素能持續減少小鼠腫瘤細胞中的ATP合成。這種活性與誘導細胞凋亡和AMPK介導的自噬有關,從而降低了腫瘤細胞的存活率。誘導細胞凋亡可能與姜黃素介導的ROS生成刺激有關,ROS生成刺激已被證明會導致前列腺癌的內質網應激。
鑒于ATP在細胞代謝中的核心作用,姜黃素對ATP合成的影響可能是其最重要的作用。減少ATP合成似乎對姜黃素作為熱量限制模擬物的活性也很重要。禁食或短期饑餓會產生強烈的反沃伯格效應,主要作用于糖酵解途徑中的酶,這一點在基因和蛋白質表達水平上都有所體現,并對整體活性產生影響。同樣,姜黃素降低了不同腫瘤細胞中關鍵糖酵解酶的活性,只有小鼠黑色素瘤細胞系B16例外,因為該細胞系的線粒體呼吸(耗氧量和ATP合成)基本上很低(見圖1)。我們認為,姜黃素處理后ATP合成進一步減少會損害細胞活力,B16細胞試圖通過提高糖酵解酶的活性來補償多酚的影響。然而,姜黃素在誘導AMPK磷酸化和自噬隨之增加方面模擬了禁食對B16細胞的影響。
姜黃素造成的能量損傷在體內也能觀察到,并最終轉化為腫瘤生長的減少。我們選擇了一種免疫缺陷小鼠模型,以便從免疫反應介導的最終效應中分辨出多酚的直接抗腫瘤效應。有趣的是,姜黃素在體內還顯示出抗血管生成的作用,這可能也是抗腫瘤活性的原因之一。
姜黃素的其他幾種抗腫瘤活性已被證實。在這里,我們關注的是其抗代謝作用。ROS介導的DNA聚合酶γ的耗損很可能是ATP合酶活性降低的結果。姜黃素對細胞微管組織的影響最近有報道,但似乎與它的代謝活動無關。姜黃素被認為可以增加化療的活性并降低其毒性,其作用可能與其對炎癥的主要調節因子NFκB的抑制活性有關。這種活性是由姜黃素抑制IkKβ介導的。而IkKβ的合成抑制劑SC-514對ATP的合成沒有影響,這表明姜黃素的兩種活性是獨立的。目前還無法確定姜黃素的抗代謝和抗炎作用在多大程度上決定了體內腫瘤生長的減少。事實上,姜黃素抑制的腫瘤進展和血管生成與NFκB介導的炎癥以及葡萄糖代謝有關。使用同樣具有抗腫瘤活性的抗糖尿病藥物二甲雙胍進行代謝干預,卻發現了部分促進血管生成活性的矛盾現象。姜黃素和二甲雙胍都通過AMPK途徑發揮作用,但姜黃素還能直接抑制ATP合成酶,可能會以更直接的方式影響內皮細胞的活力。未來的研究必須解決抑制ATP合成對血管生成的作用問題。雖然我們在這項研究中使用的是鼠癌細胞,但人類癌細胞很有可能至少具有相同的抗代謝作用。
盡管對姜黃素的研究已有十年之久,但其作用機制的一些關鍵方面仍然模糊不清。尤其是姜黃素的生物利用率低,在血液中降解和消除速度快,因此目前還不清楚在體外觀察到的姜黃素效應如何轉化為體內效應。然而,通過小鼠飲食給藥姜黃素對體內腫瘤細胞有顯著效果,這需要吸收化合物本身或其降解產物或腸道代謝物。在這里,我們將姜黃素直接注入動物的尾靜脈,以避免與生物利用度相關的問題。30毫克/千克體重相當于體重70千克的成人2.1克。目前還不清楚姜黃素溶液在人體中的靜脈注射情況,但如果能找到合適的載體,注射類似劑量的姜黃素也是可能的。不過,在化學預防方面的最終應用顯然需要口服給藥。我們使用了B16小鼠黑色素瘤細胞,這是一種成熟的黑色素瘤研究模型。我們計劃在未來的實驗中使用患者衍生的異種移植物來解決腫瘤在患者之間和患者內部的異質性問題。
姜黃素被描述為泛檢測干擾化合物(PAIN),其生物活性一直受到質疑。在本研究中,我們展示了經過嚴格控制的生物檢測數據,其中姜黃素對ATP合酶具有明顯的抑制活性,可改變癌細胞的新陳代謝,從而導致生長減慢、細胞凋亡和自噬。我們采用的所有檢測方法都不會因化合物不受控制的自發熒光而產生偏差。盡管有許多設計不合理的研究報告了有關姜黃素的不可靠數據,但這種化合物確實具有抗癌活性,正如本文所述。總之,抑制ATP合成似乎是膳食多酚姜黃素的另一個主要活性,它與已知的NFκB依賴性抗炎活性一起控制著腫瘤細胞的活力。姜黃素顯示的活性與短期饑餓觀察到的活性部分重疊,因此可被視為真正的卡路里限制或禁食模擬物。抗代謝和抗炎活性的結合使姜黃素成為預防癌癥、代謝綜合癥和其他老年性疾病的有效藥物,最終有助于延長壽命。
 相關新聞
相關新聞