熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
摘要
氧氣消耗是評估胚胎質量的有用參數,因為它提供了整體代謝活動的寶貴指示。多年來,已有幾種方法用于測量單個胚胎的呼吸速率,但尚未報道令人信服的方法。在本研究中,我們介紹并驗證了一種新型高分辨率微傳感器技術,用于確定不同發育階段單個胚胎的呼吸速率。我們采用該技術研究了呼吸速率與胚胎形態、直徑和性別之間的相關性。經過形態學評估后,測定了第3天(n=18)和第7天(n=60)牛體外生產胚胎的單個呼吸速率。在測量的胚胎中,64個通過PCR進行性別診斷的裂解。第7天胚胎的平均呼吸速率(1.30±0.064 nl/h)是第3天胚胎(0.38±0.011 nl/h)的3.4倍。在第7天,質量1的囊胚的平均呼吸速率顯著高于較低質量的呼吸速率。對于第3天和第7天胚胎,呼吸速率直接受胚胎直徑影響,但性別之間無差異。這些結果表明,新型微傳感器技術可用于準確快速(8分鐘)測量不同發育階段單個胚胎的呼吸速率。呼吸速率僅與胚胎形態部分一致,表明這兩種方法在評估胚胎質量時存在輕微差異。很可能,胚胎呼吸和形態的聯合評估將改善胚胎分類和后續選擇。
引言
形態學評估是常規用于評估牛胚胎質量和后續存活力的主要且通常是唯一技術,無論是在實驗工作還是實踐中。然而,這種評估本身是主觀的,即使 among 專業和經驗豐富的人員也常常無法達成一致。此外,基于形態學選擇胚胎已被證明是困難的,特別是對于中間形態質量的胚胎。因此,需要更客觀的選擇標準,而更好地理解胚胎代謝可能對開發判斷單個胚胎質量和發育潛力的新策略非常有用。
胚胎代謝先前已通過測量營養消耗來評估,如葡萄糖、丙酮酸和氨基酸。然而,氧氣消耗被認為是最能指示單個胚胎整體代謝活動的參數,因為三磷酸腺苷(ATP)的產生主要來自氧化磷酸化,這是一個氧氣起關鍵作用的過程。此外,早期研究提供證據表明,單個胚胎的呼吸速率直接與質量相關并與胚胎移植后的存活相關。因此,量化單個胚胎的氧氣消耗,結合形態學評估,很可能改善選擇胚胎和預測其發育能力的標準。
已有幾種方法用于測量植入前胚胎的呼吸速率。首批研究使用卡爾特潛水器技術測量大量兔卵母細胞和植入前小鼠胚胎的氧氣消耗。隨后對單個人類卵母細胞和囊胚和小鼠囊胚的研究采用分光光度法間接測量胚胎的氧氣消耗,通過確定氧合血紅蛋白轉化為血紅蛋白的量作為氧氣消耗的指標。Overstrom開發了一種帶有固態氧電極的多通道裝置,能夠測量單個小鼠和牛胚胎的氧氣消耗。然而,該原型由于靈敏度有限而未廣泛使用。此外,測量耗時,因此可能干擾胚胎的后續發育。
小群小鼠和牛胚胎的氧氣消耗也使用超微熒光技術測定。該系統利用芘的熒光特性間接測量在存在該物質的情況下培養4-6小時的胚胎群的氧氣消耗。該技術無法測量單個胚胎,而且胚胎暴露于培養基中的熒光團可能產生副作用,需要進一步評估可能的毒性副作用。
使用自參考微電極技術量化了單個無透明帶小鼠胚胎的氧氣消耗,該技術先前已用于研究各種生物系統。在該技術中,透明帶被移除,因此報告的呼吸速率可能無法準確反映完整胚胎的生理氧氣消耗。
最近,使用掃描電化學顯微鏡測定了單個牛桑椹胚和囊胚的氧氣消耗。測量需要持續顯微鏡觀察,并且每個胚胎用持卵針固定,以便在幾個定義位置進行氧氣測量,因為囊胚表面觀察到不均勻性。然而,胚胎氧氣消耗產生的梯度是雙曲線的,因此 inherently 難以測量。此外,從單個胚胎的多次測量中獲得總體呼吸速率既不準確又耗時。
測量單個胚胎氧氣呼吸速率的理想方法應是非侵入性、快速、簡單、準確、高靈敏度(能夠測量任何發育階段的單個胚胎)、可重復且不影響胚胎后續發育。
在本研究中,我們介紹并驗證了一種新型高分辨率超微呼吸系統,以高靈敏度和準確度確定單個胚胎的氧氣消耗。我們證明了所開發的系統適用于非侵入性量化不同發育階段單個胚胎呼吸速率的差異。我們進一步調查了體外生產第7天囊胚的單個呼吸速率是否與形態學質量和性別相關,或直接受胚胎直徑影響。
這項工作的初步結果較早時已呈現。
材料與方法
所有化學品均購自Sigma(美國密蘇里州圣路易斯市),除非另有說明。
納米呼吸計系統
下述超微呼吸系統購自Unisense A/S。完整系統的概述見圖1。
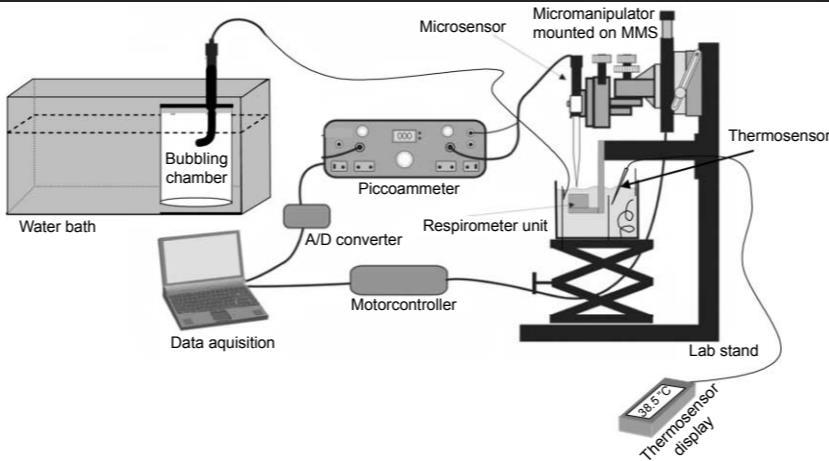
超微呼吸系統由一個氧氣微傳感器(OX50;尖端直徑40-60μm)組成,這是一種微型克拉克型氧傳感器,90%響應時間小于5秒,且氧氣消耗可忽略不計。傳感器安裝在電動微操縱器(MM33)上,牢固附著在穩定的實驗室支架(LS18)上,并連接到高靈敏度皮安計(PA2000),能夠以0.1μmol/l的分辨率記錄來自氧氣傳感器的信號。然而,此類傳感器信號對溫度變化略微敏感(每攝氏度信號增加2-3%)。皮安計通過A/D轉換器(ADC-101)連接到運行數據采集軟件(Profix版本2.2)的計算機。該軟件用于讀取和記錄來自微傳感器的數據,并通過電機控制器(MC-232)控制微操縱器。
測量單元(即玫瑰座;圖2b)由七個融合玻璃毛細管(內徑0.68mm,長度3mm)組成,底部密封玻璃,附著在UDEL聚砜(Solvay Advanced Polymers L.L.C, 美國佐治亞州阿爾法利塔市)玫瑰座盤上。玫瑰座放入UDEL聚砜玫瑰座盤支架中,該支架通過金屬框架附著到實驗室支架上。這三個組件形成納米呼吸單元(圖2C)。

為確保測量過程中氧氣和溫度條件穩定,專門制作了一個大型玻璃孵化室,內含加熱螺旋和一個小燒杯。加熱螺旋通過兩根硅膠管連接到溫度控制水浴。大型玻璃孵化室充滿蒸餾水,放在升降臺和磁力攪拌器上。孵化室中水的溫度由熱傳感器(TP50;Unisense A/S)監測,并維持在38.5°C。通過氣泡泵(AP50)產生氣泡,在玻璃孵化室內產生連續循環的熱水。燒杯內培養基(80ml SOFaaci)由合成輸卵管培養基與氨基酸、檸檬酸和肌醇組成,補充有抗生素(硫酸慶大霉素,10mg/ml)和5%牛血清(CS;丹麥獸醫研究所,丹麥腓特烈斯貝)。該培養基在恒定流動的濕潤5% CO2在19% O2中保持,并在半封閉系統中,因為燒杯用塑料蓋覆蓋,中心有開口。通過小磁力攪拌器實現燒杯內培養基的輕柔混合。
氧氣微傳感器在至少極化2小時后進行兩點校準。第一點(0% O2)使用抗壞血酸(50ml抗壞血酸鈉在50ml NaOH, 0.1M中)。第二點(19% O2)在校準時精確的溫度、鹽度和氧氣條件下進行,這些條件與胚胎在實際測量過程中經歷的相同。
最初,傳感器預定位在玫瑰座中一個玻璃毛細管的上開口和中心(即零深度)。這使用解剖顯微鏡(GZ4;Leica Microsystems, 德國韋茨拉爾)手動執行。隨后,系統的“轉輪”設計確保通過旋轉玫瑰座輕松將玫瑰座中的其他毛細管帶入分析位置。
體外胚胎生產
用于體外生產的方法已在別處報道。簡而言之,牛未成熟卵丘-卵母細胞復合體(COCs)從屠宰場獲得的卵巢中抽吸,選擇(即排除裸露的COCs和有明顯退化跡象的COCs)并在四孔培養皿(Nunc, 丹麥羅斯基勒)中成熟24小時。每個孔含有400μl碳酸氫鹽緩沖的TCM-199培養基(Gibco BRL, 英國斯特拉斯克萊德佩斯利),補充有15% CS、10IU/ml馬絨毛膜促性腺激素和5IU/ml人絨毛膜促性腺激素(Suigonan Vet;Intervet Scandinavia, 丹麥斯科夫倫德)。卵母細胞在礦物油下于38.5°C在5% CO2濕潤空氣中成熟。受精在改良的Tyrode培養基中進行,使用凍融、Percoll選擇的精子。22小時后,通過渦旋去除卵丘細胞,推定合子轉移到400μl培養培養基中,并在38.5°C在5% CO2、5% O2、90% N2氣氛中孵化,最大濕度。胚胎在12個獨立重復中體外生產,每次重復使用約50個卵母細胞。
 相關新聞
相關新聞