熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
有氧糖異生條件下的LEE基因表達。
AE病變形成依賴于LEE基因表達,先前研究在有氧糖異生生長條件下顯示Cra和KdpE激活而FusR抑制LEE基因轉錄。然而,Cra、KdpE和FusR之間的潛在交叉對話尚未被研究。為了assay刪除cra、kdpE或fusR(單獨或組合)是否影響LEE基因轉錄,突變體在有氧低葡萄糖和丙酮酸培養基中生長(與上述assay相同培養基)。測量代表兩個LEE操縱子eae和espA的基因表達。Δcra、ΔkdpEΔcra、ΔfusRΔcra和ΔfusRΔkdpEΔcra菌株顯著降低LEE基因表達(圖2B)。ΔkdpE和ΔfusRΔkdpE突變菌株的LEE基因表達水平略高于但相似于WT,而ΔfusR菌株顯著增強LEE基因表達。為了確認我們的定量逆轉錄(qRT)-PCR數據,使用Western blot assay測量LEE編碼的效應器EspB的分泌(其與espA在同一LEE4操縱子中編碼)(圖2C)。綜合來看,這些數據再次表明Cra在這些生長條件下強烈激活LEE表達而FusR抑制它。在三個調節器中,Cra對LEE基因表達的影響最主導。
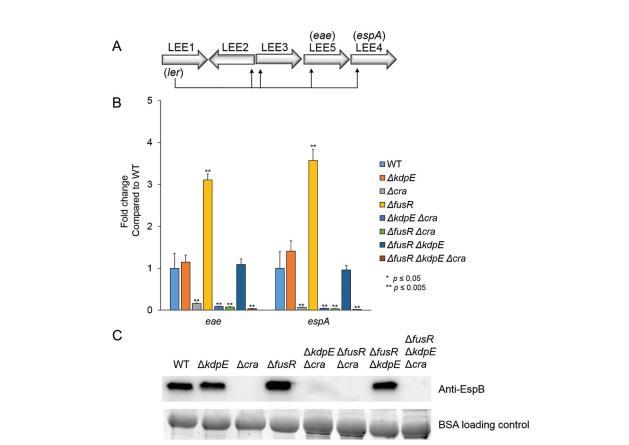
由于丙酮酸是一個關鍵中心代謝物且Cra活性依賴于糖異生條件的感知,單突變、雙突變和三突變菌株在有氧僅低葡萄糖中生長以去除丙酮酸作為潛在混淆變量。獨立于丙酮酸,Cra仍然在Δcra、ΔkdpEΔcra、ΔfusRΔcra和ΔfusRΔkdpEΔcra菌株中顯著降低eae和espA表達(圖3A)。eae表達在ΔkdpE菌株中也顯著降低,而espA表達未變(圖3A)。這些結果與我們先前報告一致。EspA在LEE4操縱子中編碼,其表達受高水平轉錄后調控,包括RNA結合蛋白CsrA。
因此,一個潛在解釋是espA(LEE4)在kdpE突變體中相對于eae的差異調控(圖3A)和ler可能是LEE4操縱子的轉錄后調控。此外,與espA在同一操縱子中轉錄的sec基因在Δcra、ΔkdpEΔcra、ΔfusRΔcra和ΔfusRΔkdpEΔcra中顯著降低(表明Cra是LEE基因表達的激活劑,獨立于丙酮酸)。令人驚訝的是,刪除fusR產生與WT相似的eae基因表達水平,而espA水平在fusR突變體中顯著升高,表明丙酮酸以某種方式影響FusR如何抑制LEE。相應的分泌EspB的Western blot assay顯示ΔfusR菌株水平與WT相似,而ΔkdpE和ΔfusRΔkdpE菌株水平略高于WT(圖3B)。這些數據表明丙酮酸影響氧氣存在時FusR抑制LEE的程度。潛在情況下,EHEC可能經歷一旦腸道上皮被細胞死亡破壞,導致富含氧氣和丙酮酸的血液注入環境。然而,在感染某個時刻,EHEC可能需要抑制其T3SS以移動到下一個生態位環境,FusR可能幫助這種過渡。
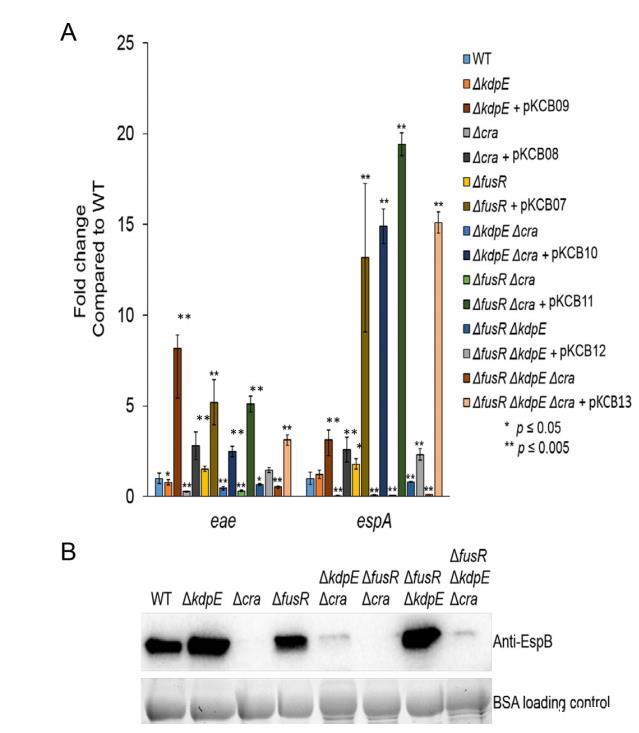
為了確認缺失菌株未表現極性效應,所有菌株被互補并在有氧糖異生條件下生長。測量互補菌株的eae和espA表達(圖3A)。
丙酮酸對LEE基因轉錄和EspB分泌的影響。
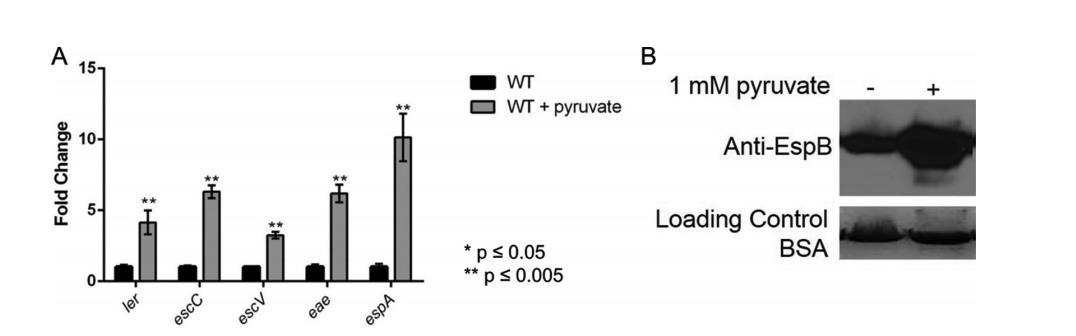
給定丙酮酸對FusR及其LEE調控的影響,我們進一步研究丙酮酸如何影響EspB(其與espA共轉錄)的分泌。WT EHEC在有氧低葡萄糖DMEM中生長,有或無1 mM丙酮酸。添加丙酮酸導致所有測試LEE基因的過表達并增加EspB分泌(圖4A和B)。這種表達差異不是由于生長優勢,因為EHEC在有或無丙酮酸生長時有相似世代時間。雖然這些條件不準確模擬流動人血中的條件,結果可能表明一旦EHEC感染在腸道中變得血性,氧氣和丙酮酸的流入可能影響EHEC如何調控LEE基因表達。這可能是一個動態過程,Cra、KdpE和FusR轉變LEE基因表達是被激活還是抑制。
氧氣可用性對LEE基因轉錄和EspB分泌的影響。
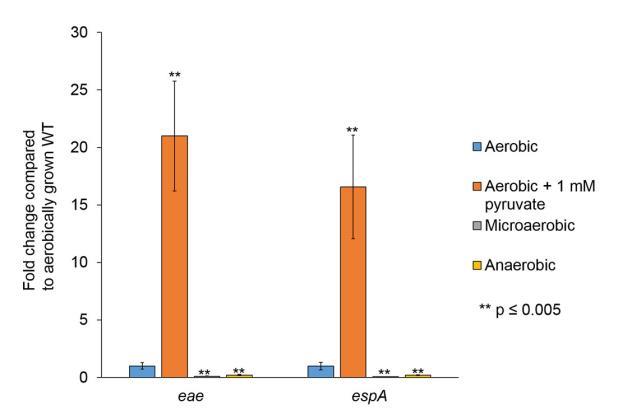
除了丙酮酸和糖源在LEE基因表達中的作用外,腸道中的氧氣可用性從腸腔到上皮表面變化。我們接下來問LEE基因轉錄是否在厭氧或微氧條件下改變。腸腔(EHEC遇到的第一個位點)主要是厭氧的。由于更少細菌存在near上皮頂表面,氧氣可以擴散穿過腸細胞,創建微氧環境。最近,顯示微生物群也可以影響腸道中的氧氣可用性。此外,Citrobacter rodentium(廣泛用作EHEC鼠類感染替代模型)通過LEE編碼的T3SS活性觸發結腸增生,增加黏膜表面氧合,導致C.rodentium有氧擴張。EHEC和C.rodentium緊密附著腸細胞在一個可能從微氧變為有氧的環境中。LEE基因表達在厭氧條件下(在厭氧室中生長)被抑制,而在有氧條件下增強,并在有氧加丙酮酸條件下達到更高水平(圖5)。
為了研究Cra、FusR和KdpE在厭氧條件下調控的貢獻,我們生長WT EHEC和單突變、雙突變、三突變菌株在厭氧低葡萄糖條件下測量LEE基因表達以及EspB分泌。與有氧條件不同,KdpE在ΔkdpE和ΔfusRΔkdpE菌株中對eae和espA有強抑制效應,而在ΔkdpEΔcra菌株中,eae表達顯著增加(圖6A)。EspB分泌在ΔkdpE、ΔkdpEΔcra和ΔfusRΔkdpE菌株中與WT相比增強(圖6B)。FusR有與WT相似表達水平(圖6A)。Cra再次在Δcra、ΔfusRΔcra和ΔfusRΔkdpEΔcra菌株中顯著降低eae表達,并在Δcra和ΔfusRΔkdpEΔcra菌株中降低espA表達(圖6A)。EspB分泌在Δcra、ΔfusRΔcra和ΔfusRΔkdpEΔcra菌株中顯著降低,再次表明Cra是強LEE激活劑(圖6B)。
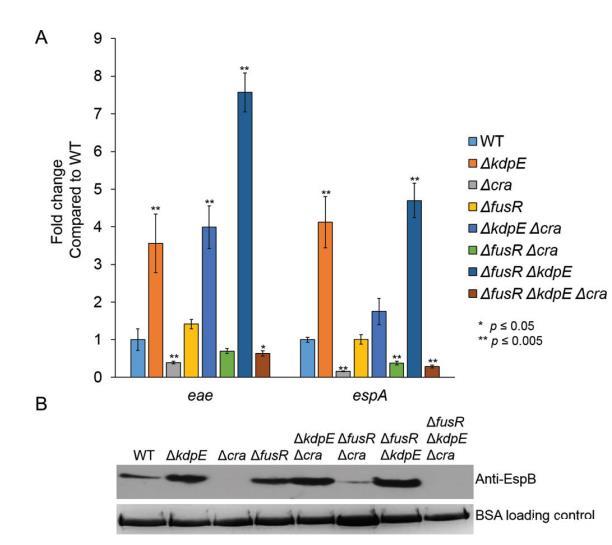
當我們生長WT EHEC和所有突變體在微氧條件下(氧氣濃度在微氧和有氧條件下測量,我們看到強調抑制和激活表型被ameliorated,除了ΔfusRΔkdpEΔcra菌株(圖7A)。EspB分泌與WT相比也不顯著差異(圖7B)。總體而言,這些數據表明氧氣存在或缺乏顯著改變EHEC如何通過Cra、KdpE和FusR調控LEE基因表達。
EHEC在腸道中發現的不同糖上的生長。
由于腸道有不同氧氣濃度,特別是在上皮細胞表面附近,且EHEC改變其毒力武器庫表達依賴于可用氧氣,我們接下來問有限氧氣可用性如何影響EHEC在腸道可用糖上的生長。EHEC和共生E.coli主要消耗單糖。人類腸道中E.coli可利用的黏蛋白衍生糖包括葡萄糖、巖藻糖、半乳糖、唾液酸、N-乙酰半乳糖胺、N-乙酰葡萄糖胺、果糖、木糖和甘露糖。然而,代謝哪些單糖的偏好differ between EHEC和共生E.coli。缺陷于以下代謝途徑的EHEC菌株與WT菌株相比有定植缺陷:巖藻糖(ΔfucAO)、核糖(ΔrbsK)、甘露糖(ΔmanA)、阿拉伯糖(ΔaraBAD)、N-乙酰葡萄糖胺(ΔnagE)和半乳糖(ΔgalK)。切換到替代、更少豐富碳源的能力因此是EHEC定植腸道的關鍵。
饋入Embden-Meyerhof-Parnas(EMP)途徑的單糖是E.coli的偏好碳源。然而,病原體經常利用非偏好碳源以獲得生態位優勢。為了測量來自大腸的特定黏蛋白衍生糖的影響,我們生長WT EHEC和每個缺失菌株在DMEM中individual糖并在氧有限微氧條件下測量總體世代時間,一個EHEC移動接近上皮表面時最可能經歷的環境條件。
表1:突變菌株在黏蛋白衍生糖中的世代時間| 糖條件 | 平均世代時間(分鐘)±標準差 | |||||||
|---|---|---|---|---|---|---|---|---|
| WT | ΔkdpE | Δcra | ΔfusR | ΔkdpEΔcra | ΔfusRΔcra | ΔfusRΔkdpE | ΔfusRΔkdpEΔcra | |
| 0.1%葡萄糖 | 90.5±16.0 | 101.2±12.6 | 85.9±15.3 | 106.3±14.0 | 67.0±0.1 | 90.2±9.1 | 78.2±12.5 | 90.5±2.2 |
| 0.4%葡萄糖 | 78.2±4.3 | 116.8±29.1 | 75.0±12.7 | 120.1±37.5 | 71.4±1.2 | 132.3±9.0a | 74.2±20.5 | 102.2±9.63 |
| 0.4%半乳糖 | 134.9±23.9 | 199.6±39.6 | 92.0±28.9 | 197.0±7.0 | 219.2±9.2 | 183.7±6.2 | 152.7±21.3 | 164.9±6.4 |
| 0.4%果糖 | 168.9±24.9 | 211.0±12.0 | 148.6±3.6 | 233.4±6.9 | 150.5±26.6 | 191.0±12.7 | 160.7±31.6 | 169.5±5.5 |
| 0.4%甘露糖 | 115.6±5.5 | 113.5±3.1 | 104.3±25.7 | 137.6±18.0 | 82.4±13.9 | 124.4±26.8 | 108.0±7.9 | 116.8±19.3 |
| 0.4%N-乙酰葡萄糖胺 | 113.7±12.7 | 174.2±6.0 | 130.2±8.8 | 184.4±2.7 | 164.9±7.1 | 146.9±28.5 | 134.4±10.2 | 139.0±19.1 |
| 0.4%N-乙酰半乳糖胺 | 136.4±23.0 | 170.3±34.5 | 196.7±66.1 | 153.3±7.9 | 135.6±40.7 | 175.6±41.5 | 119.6±11.3 | 253.2±29.6 |
| 0.4%唾液酸 | 109.7±8.9 | 131.8±15.3 | 139.3±7.9 | 148.1±13.0 | 121.6±7.7 | 144.0±36.6 | 116.2±38.9 | 145.1±28.2 |
| 0.4%鼠李糖 | 137.3±4.5 | 174.1±21.3 | 133.4±21.4 | 151.6±28.5 | 98.0±10.7 | 103.2±3.3a | 106.3±7.0a | 121.5±12.8 |
| 0.4%巖藻糖 | 125.6±48.1 | 186.2±0.9 | 270.3±142.2 | 138.7±18.8 | 138.7±18.8 | 167.5±31.7 | 130.6±20.0 | 204.6±30.1 |
| 0.4%丙酮酸 | 138.2±12.7 | 172.3±10.5 | 無生長 | 171.9±9.3 | 無生長 | 無生長 | 109.0±12.2 | 無生長 |
| 0.4%半乳糖醛酸 | 45.6±0.7 | 59.9±4.1 | 67.7±7.6 | 52.1±4.8 | 78.5±11.4 | 103.4±1.7a | 52.8±8.4 | 107.0±3.7a |
| 0.4%葡萄糖酸 | 108.9±18.1 | 187.3±13.5a | 142.8±24.0 | 157.0±25.0 | 103.1±36.4 | 123.2±9.0 | 119.0±5.4 | 164.1±7.8 |
| 0.4%葡萄糖醛酸 | 120.9±23.9 | 187.3±13.5 | 132.5±38.5 | 150.4±46.2 | 103.7±35.5 | 121.3±11.6 | 119.0±5.4 | 153.1±15.8 |
| 0.4%阿拉伯糖 | 160.6±13.4 | 217.4±11.9a | 126.4±10.8 | 204.6±4.5 | 167.7±31.1 | 135.9±28.5 | 154.0±32.5 | 128.3±9.1 |
| 0.4%木糖 | 103.2±18.4 | 130.5±16.6 | 87.6±11.6 | 168.6±25.7 | 108.9±50.3 | 104.7±31.0 | 120.6±66.5 | 122.4±29.3 |
| 0.4%核糖 | 116.7±2.2 | 198.1±1.6a | 217.5±7.3a | 185.0±6.0a | 195.6±16.0 | 258.0±24.8 | 176.3±15.7 | 96.6±12.3 |
a與WT在相同糖條件下生長相比有顯著差異(P>0.05, Student's t檢驗)
表2翻譯:本研究使用的引物列表| 引物名稱 | 序列(5'→3') | 用途 |
|---|---|---|
| JcraredF | ATGAGTAAAGGTAAACTGGTAAG | Δcra突變構建 |
| JcraredR | TTACGCAGTCGAGTTCTTCAC | Δcra突變構建 |
| kdpEARed-F | ATGAATAAACGCCTGACCGT | ΔkdpE突變構建 |
| kdpEλRed-R | TCAGGCGTAATACGACTCAC | ΔkdpE突變構建 |
| Z0463lambdaredP1 | ATGAAACGTCTGAAAGCGT | ΔfusR突變構建 |
| Z0463lambdaredP2 | TTATTTTTCAGCGTCAGGC | ΔfusR突變構建 |
| KCB topo cra FW | CACCATGAGTAAAGGTAAACTGG | cra基因克隆 |
| KCB topo cra RV | TTACGCAGTCGAGTTCTTC | cra基因克隆 |
| KCB topo kdpE FW | CACCATGAATAAACGCCTGAC | kdpE基因克隆 |
| KCB topo kdpE RV | TCAGGCGTAATACGACTC | kdpE基因克隆 |
| Z0463for | CACCATGAAACGTCTGAAAGCG | fusR基因克隆 |
| Z0463rev | TTATTTTTCAGCGTCAGGCG | fusR基因克隆 |
| Pcat to cra FW | GATCGAGCTCGGTACCCGGG | 互補載體構建 |
| Puc19 to cra RV | GCCGTCGACTCTAGAGGATC | 互補載體構建 |
| pcat to kdpE FW | GATCGAGCTCGGTACCCGG | 互補載體構建 |
| puc19 to kdpE RV | GCCGTCGACTCTAGAGGAT | 互補載體構建 |
| pcat to fusR FW | GATCGAGCTCGGTACCCG | 互補載體構建 |
| puc19 to fusR RV | GCCGTCGACTCTAGAGGA | 互補載體構建 |
| p184kdpE to cra FW | GATCGAGCTCGGTACCC | 雙基因互補載體 |
| p184 to cra RV | GCCGTCGACTCTAGAGG | 雙基因互補載體 |
| p184 to kdpE FW | GATCGAGCTCGGTACC | 雙基因互補載體 |
| p184cra to kdpE RV | GCCGTCGACTCTAGAG | 雙基因互補載體 |
| p184 to fusR FW | GATCGAGCTCGGTAC | 雙基因互補載體 |
| p184kdpE to fusR FW | GATCGAGCTCGGTA | 雙基因互補載體 |
| p184cra to fusR RV | GCCGTCGACTCTAGA | 雙基因互補載體 |
| p184fusR to cra FW | GATCGAGCTCGGT | 雙基因互補載體 |
在糖酵解(高葡萄糖)條件下,EHEC有78.2±4.3分鐘的世代時間(表1)。令人驚訝的是,WT EHEC在galacturonic acid(一個Entner-Doudoroff(ED)途徑糖)中生長時有45.6±0.7分鐘的世代時間。ΔkdpE、Δcra、ΔfusR和ΔfusRΔkdpE突變菌株在galacturonic acid中也有比葡萄糖短的世代時間。EHEC在所有其他糖中生長比葡萄糖慢。EHEC世代時間在比葡萄糖長1小時內的多數黏蛋白衍生糖包括木糖(103.2±18.4)、gluconic acid(108.9±18.1分鐘)、唾液酸(109.7±8.9分鐘)、N-乙酰葡萄糖胺(113.7±12.7分鐘)、甘露糖(115.6±5.5分鐘)、核糖(116.7±2.2)、glucuronic acid(120.9±23.9)、巖藻糖(125.6±48.1)、半乳糖(134.9±23.9)、N-乙酰半乳糖胺(136.4±23.0分鐘)和丙酮酸(138.2±12.7分鐘)。EHEC世代時間在比葡萄糖長2小時內的糖包括rhamnose(137.3±4.5)、阿拉伯糖(160.6±13.4分鐘)和果糖(168.9±24.9分鐘)(表1)。
無任何kdpE、cra或fusR突變的菌株生長顯著優于WT EHEC。我們驚訝ΔfusR突變體在僅巖藻糖中生長不比WT快,如先前有氧生長培養顯示。這種差異可能源于在微氧條件下生長此突變體,進一步表明這些轉錄因子對可用氧氣的敏感性。然而,對于六種糖,突變菌株有比WT生長相同碳源顯著更差的世代時間(表1)。對于丙酮酸,應注意到攜帶Δcra突變的菌株failed to grow,如先前證明。
EHEC在不同糖上生長時改變毒力蛋白分泌。
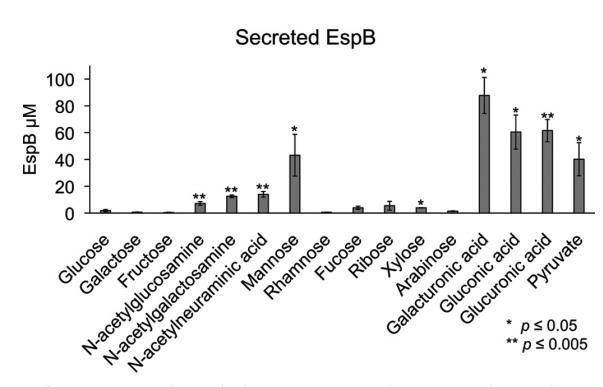
給定WT EHEC與不同黏蛋白衍生糖的世代時間差異,我們接下來問這些不同糖是否影響LEE編碼蛋白EspB的表達。WT EHEC和ΔespB突變菌株在微氧條件下生長到早期穩定期before生長停止。在所有測試糖中,ΔespB突變菌株生長類似WT EHEC。如預期,WT EHEC在高葡萄糖條件下表達低濃度EspB(圖8)。當半乳糖、果糖、rhamnose、巖藻糖、核糖、木糖或阿拉伯糖作為唯一碳源時也觀察到低EspB產生。當galacturonic acid、gluconic acid、glucuronic acid、丙酮酸、唾液酸或甘露糖作為唯一碳源時,EspB分泌substantially增加。當N-乙酰葡萄糖胺和N-乙酰半乳糖胺使用時觀察到EspB分泌適度增加。這些數據證明利用至少八種替代糖由EHEC可以促進毒力基因的表達和分泌。
 相關新聞
相關新聞