熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
RNA提取和qRT-PCR
對于有氧搖動生長的EHEC菌株,培養在0.1%葡萄糖有或無1 mM丙酮酸DMEM中到OD600 1.0。互補EHEC菌株在有氧搖動0.1%葡萄糖DMEM中生長到OD600 1.0。對于靜態(微氧)或厭氧室中生長的EHEC菌株,培養6小時到早期穩定期在0.1%葡萄糖DMEM中到OD600 0.6。從三個重復提取RNA用RiboPure細菌分離kit according制造商協議(Ambion)。如先前描述執行qRT-PCR。簡要地,稀釋提取RNA與驗證引物、RNase抑制劑和逆轉錄酶(AB)混合。混合物用于一步反應利用ABI 7500序列檢測系統。用ABI序列檢測1.2軟件收集數據,標準化到內源rpoA水平并通過比較臨界閾值方法分析。分析數據表示為相對WT水平的fold變化。使用Student未配對t檢驗確定統計顯著性。P值<0.05認為顯著。
分泌蛋白的Western blot assay
從培養在0.1%葡萄糖有或無1 mM丙酮酸DMEM中,如先前描述分離分泌蛋白。加20μg牛血清白蛋白到分泌蛋白樣品作為加載對照。蛋白通過12%SDS-PAGE分離,轉移到PVDF膜,并用10%牛奶在PBS含0.05%Tween中封閉。膜用抗EspB一抗探測,洗滌,然后孵育與鏈霉親和素-HRP偶聯的二抗。加GE增強化學發光試劑,膜暴露于膠片或用Bio-Rad ChemiDoc Touch成像系統(軟件1.0.0.15)與Image Lab 5.2.1軟件顯示圖像。每個生長條件最少重復三次。
熒光素肌動蛋白染色assay
如先前描述執行熒光素肌動蛋白染色assay。簡要地,HeLa細胞生長過夜到約80%匯合在37°C 5%CO2 on coverslips在孔中含DMEM補充10%胎牛血清和1%青霉素-鏈霉素-谷氨酰胺抗生素混合物。感染前,用無抗生素新鮮培養基替換過夜培養基。為感染HeLa細胞,過夜靜態細菌培養稀釋100:1(細菌到DMEM)。感染3小時后,孔再次替換無抗生素新鮮培養基。感染6小時后,coverslips洗滌、固定和透化。樣品處理with FITC標記鬼筆環肽可視化肌動蛋白積累和碘化丙啶可視化細菌DNA和HeLa細胞核。然后安裝coverslips on slides并用Zeiss Axiovert顯微鏡成像。Pedestal形成量化為每個附著細菌形成pedestal的百分比。量化多個實驗的重復coverslips,并用Student未配對t檢驗進行統計分析。原始細菌培養系列稀釋也鋪板以確認相似CFU比率用于感染。
微氧生長曲線和世代時間與黏蛋白衍生糖
過夜培養稀釋1:100到96孔Costar板在0.4%指示糖在DMEM中。糖全部購自Sigma,包括D-(+)-木糖、丙酮酸鈉、D-(-)-果糖、L-鼠李糖一水合物、D-(-)-核糖、L-(-)-巖藻糖、D-(+)-半乳糖、N-乙酰-D-半乳糖胺、N-乙酰-D-葡萄糖胺、N-乙酰神經氨酸、D-葡萄糖醛酸鈉一水合物、D-半乳糖醛酸鈉、D-葡萄糖酸鈉、D-(+)-甘露糖、D-(+)-葡萄糖和L-(+)-阿拉伯糖。用BMG Labtech FLUOstar Optima微板讀數器(軟件版本2.10R2,固件版本1.24)每小時測量OD前8小時和再次在24小時生長。數據線性和半對數繪圖。世代時間從半對數曲線線性部分計算如下:Gt=時間×log(2)/(log最終濃度-log初始濃度)。
蛋白純化和ELISA
pET21基質粒表達EspB用IPTG誘導,并用鎳柱純化蛋白(Qiagen)。His-EspB緩沖交換到PBS用Amicon過濾器before稀釋for標準對照。對于酶聯免疫吸附assay(ELISA),過夜WT和ΔespB突變EHEC培養稀釋1:100到96孔板在0.4%指示糖在DMEM中。用BMG Labtech FLUOstar Optima微板讀數器測量早期穩定生長階段OD600以確認兩菌株生長可比。用4X STOP溶液(0.92 M疊氮化鈉和100μl Sigma蛋白酶抑制劑混合物在PBS中)淬滅細菌生長。淬滅反應混合物稀釋1:2并孵育在Dynatech Laboratories Microtitter ELISA板中。孔用5%牛奶在PBST中封閉。樣品在PBST中洗滌prior孵育與抗EspB一抗和鏈霉親和素-HRP偶聯的二抗。板用Sigma TMB顯色并用2N HCl停止。用BMG Labtech FLUOstar Optima微板讀數器測量OD450,基于已知對照蛋白標準曲線計算EspB濃度。使用Student未配對t檢驗確定統計顯著性。P值<0.05認為顯著。
結果
Cra、KdpE和FusR在生長和毒力中的關系。
轉錄因子Cra、KdpE和FusR直接結合ler調控區以控制LEE基因表達。為了解決這些轉錄因子在LEE調控中的相互作用,我們構建了ΔkdpE、ΔkdpEΔcra、ΔfusRΔcra、ΔfusRΔkdpE和ΔfusRΔkdpEΔcra EHEC缺失菌株。單獨刪除cra、kdpE或fusR的EHEC無生長缺陷,如先前報道。然而,組合刪除這些基因可能損害細菌生長。為了確定雙突變和三突變菌株是否與野生型(WT)在生長上可比,構建的缺失菌株在LB或0.1%葡萄糖加1 mM丙酮酸的Dulbecco改良Eagle培養基(DMEM)中生長。所有缺失菌株與WT EHEC相比無生長缺陷。
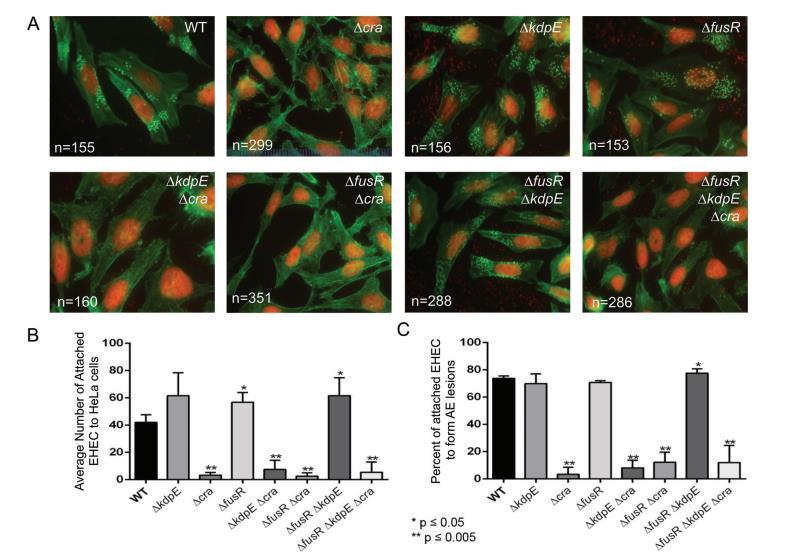
由于Cra、KdpE和FusR影響LEE基因表達(這是AE病變形成所必需的),我們接下來評估了這些轉錄因子在AE病變形成調控中的作用。為了形成AE病變,EHEC使用專門效應器緊密附著哺乳動物細胞并重組肌動蛋白以包裹細菌,形成pedestal樣結構。為了assay刪除cra、kdpE或fusR(單獨或組合)是否影響EHEC AE病變形成,感染HeLa細胞并評估形成的AE病變數量和每個病變附著的細菌數量。與WT細菌(41.99±5.46)相比,ΔfusR(56.74±7.11)和ΔfusRΔkdpE(61.52±13.07)菌株顯著更多細菌附著HeLa細胞,分別有73.68%、70.67%和77.44%的附著細菌能夠形成AE病變(圖1A至C)。任何刪除cra的菌株附著HeLa細胞或與AE病變相關的細菌數量顯著減少。雖然ΔkdpE菌株有更多附著細菌(61.56±16.74),69.86%形成pedestals,與WT相比,這些數據不顯著。總體而言,這些數據表明Cra是EHEC中AE病變形成的強激活劑;然而,單獨刪除fusR或與kdpE組合顯示這些調節器在EHEC附著HeLa細胞前抑制或改變AE病變形成的動力學。
 相關新聞
相關新聞