熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
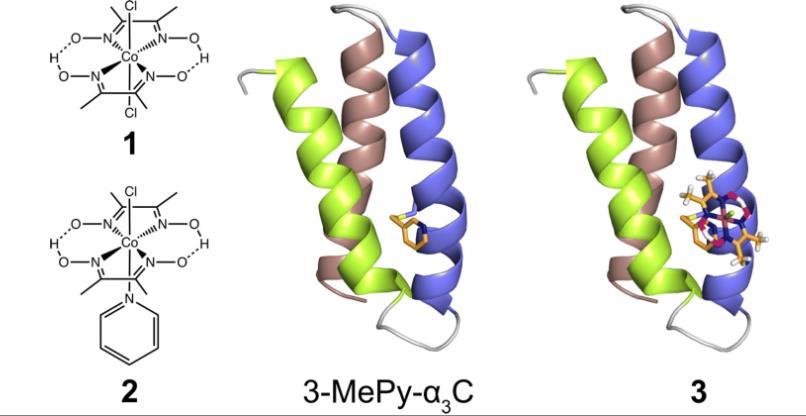
圖1、左:本研究中使用的鈷氧化肟:[Co(dmgH)2Cl2](1),和[Co(dmgH)2(py)Cl](2)。中心:基于相關蛋白系統2MP-α3 C(2MP=2-巰基酚),RSCB PDB ID 2LXY的3-MePy-α3 C(3-MePy=3-甲基吡啶)結構模型。α3腳手架中的螺旋1、2和3分別以青檸綠、藍色和灰褐色呈現。右圖:基于3-MePy-α3C的人工氫化酶模型。
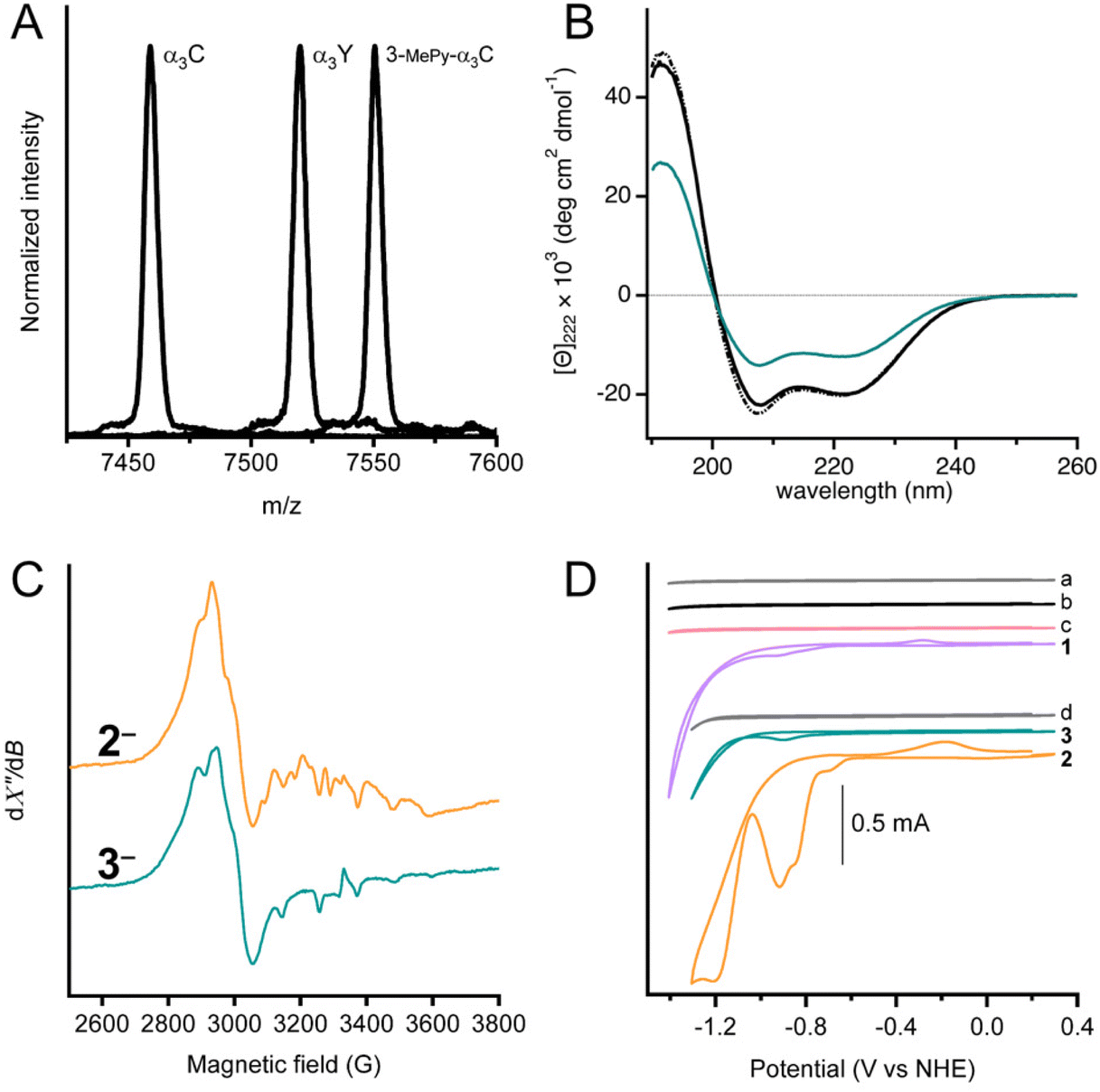
圖2、復雜體3的特征描述。(A)使用辛那匹酸基質進行α3C、3-MePy-α3C和α3Y的MALDI-ToF-MS光譜儀。每個樣品的計算質量(mc)和觀測質量(m/z)如下:α3C(mc=7460.8,m/z=7458.9)、3-MePy-α3C(mc=7551.9,m/z=7550.5)、α3Y(mc=7520.8,m/z=7520.1)。
(B)圓二色性譜,單位為平均剩余摩爾橢圓度[Θ],適用于50 mM KP、pH 7.0±0.1中的α3W(黑色點劃線)、α3C(實心黑色)和3(青綠色)。
(C)冷凍溶液化學還原樣品的X波段EPR光譜,2?和3?。光譜記錄在T=7 K,使用1毫瓦微波功率。
(D)堆疊的循環伏安圖,包括100 mM KP pH 7緩沖液(掃描A,灰色)、α3C蛋白膜(掃描b,黑色)、3-MePy-α3C蛋白膜(掃描c,粉色)、0.47 mM 1(掃描1,紫色)、100 mM MES、100 mM MOPS、75 mM KCl緩沖液(掃描D,灰色)、蛋白膜3(掃描3,青綠色)和1.0 mM 2蛋白膜(掃描2,橙色)。CVsa–c和CV1在100 mM KP、pH 7.0±0.1緩沖液中記錄。CVd、2和3采集于100 mM MES、100 mM MOPS pH 7.0緩沖液中。所有測量均采用250 mV s?1的掃描速率。
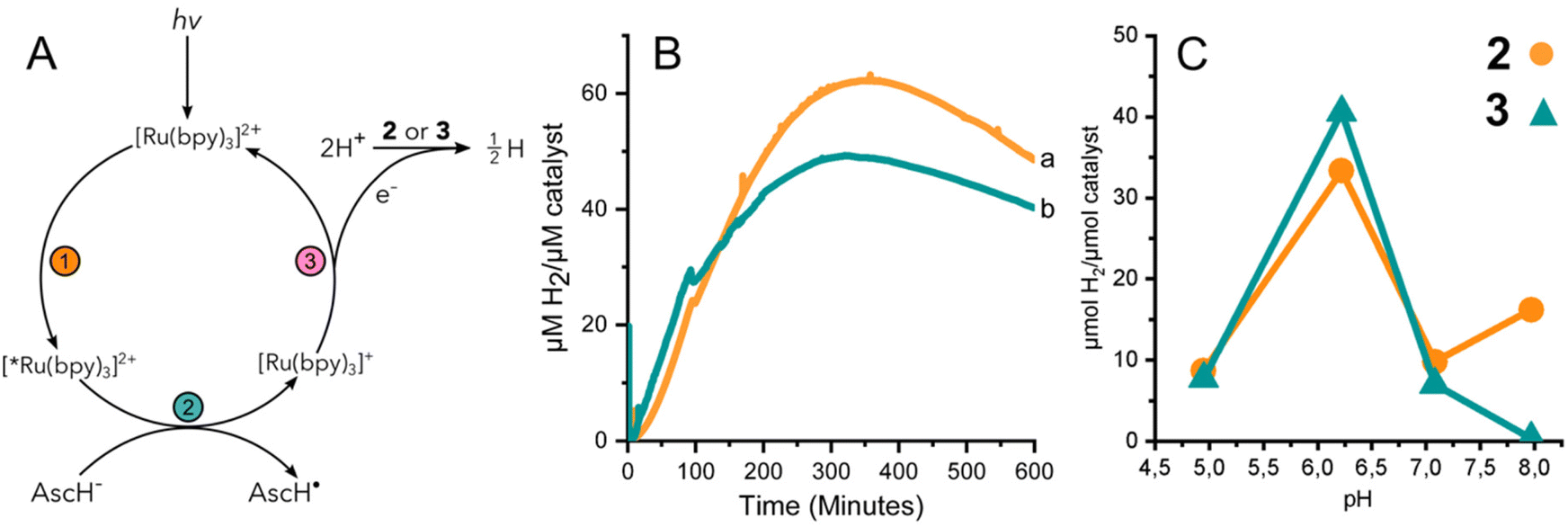
圖3(A)光激活HER的反應方案。(B)H2由2(a,橙色)和3(b,青綠色)在光催化條件下pH 6.2產生。通過H2感應電極檢測。(C)在反應完備時,在pH條件下的頭間檢測到H2。
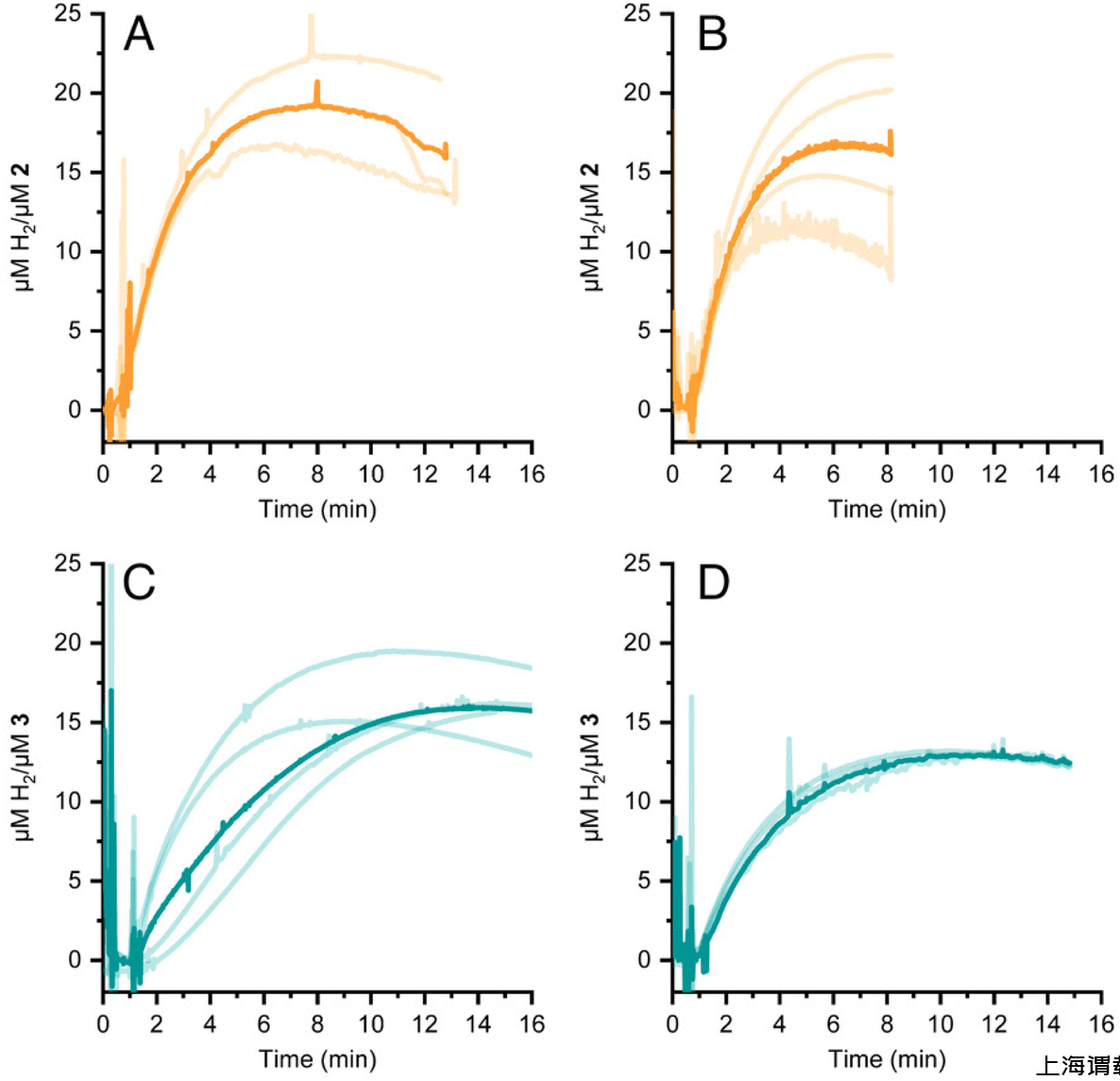
圖4、通過添加化學還原劑[Eu(EGTA)]誘導的HER 2(面板A和B)和3(面板C和D)。pH值為7(面板A和C)或8(面板B和D)。每個光跡代表獨立的檢測;粗體為光線痕量的平均值。
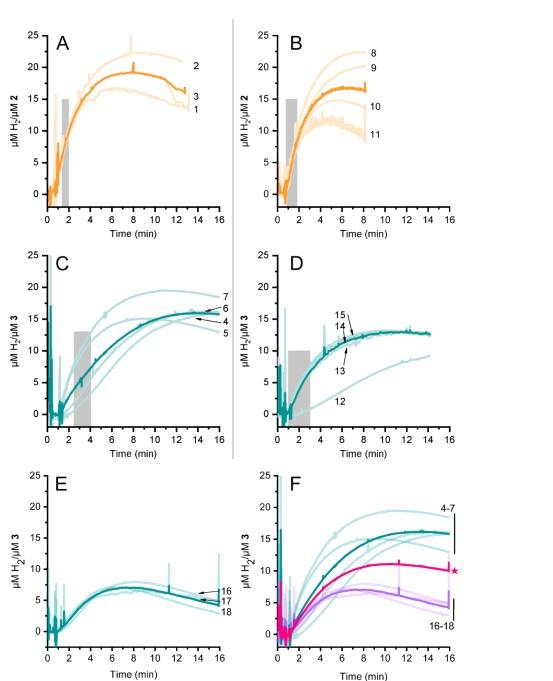
圖5、通過克拉克型氫傳感器檢測到的化學式氫析出現象。氫氣在化學還原劑[Eu(EGTA)]2-的存在下由2和3發生演變。亮色痕跡是單獨的測量值;暗色痕跡則是重復測量的平均值。1至15號痕跡是在同一天記錄的,因此更具可比性。16至18號痕跡是在另一天記錄的。數字與表S1中的樣本編號相對應。陰影灰色區域顯示了用于繪制線性曲線以確定表1中所報告的氫產量速率的數據。(A)復合物2,pH值7。(B)復合物2,pH值8。(C)復雜物3,pH值7。(D)復雜物3,pH值8。(E)復雜物3,在不同日期的pH值為7時的情況。(F)所有氫氣釋放痕跡(4-7—藍色,痕跡4-7)以及(16-18—紫色,痕跡16-18)均針對pH值為7的3號樣品。
結論與展望
基于豐富元素且能在中性水中發揮作用的分子催化劑,是可持續氫氣生產的重要組成部分。基于蛋白質-無機雜交的人工氫化酶已成為這一目的中一類引人注目的催化劑。研究人員制備了一種基于鈷肋的新型人工氫酶,通過基于吡啶的非天然氨基酸結合到新生的三α螺旋蛋白α3C。功能化的新生蛋白通過紫外可見光譜、CD光譜和EPR光譜以及MALDI光譜法進行了表征,確認鈷氧肟與該蛋白的存在及連接。
新的新酶在中性水溶液中通過電化學、光化學和還原化學條件下生成氫。與天然鈷氧化肟相比,新酶的氫演化能力發生變化,周轉率約為鈷氧化肟的80%,氫的演化率為鈷氧化肟的40%。
本研究為如何為鈷氧化羋作為蛋白質環境中氫演化催化劑的功能提供重要信息,以及利用新生蛋白開發人工金屬酶的可行性。作為酶支架的小型新生蛋白具有作為高效原子經濟性,具有作為可升級生物啟發催化劑的潛力,而本文的研究結果表明,這類新型酶是可能的產物。
Unisense公司的氫氣微傳感器(H?)來監測反應體系中由鈷肟催化劑(游離態2或蛋白結合態3)在[Eu(EGTA)]2?還原條件下產生的氫氣。通過實時測量H?積累速率和總量,研究人員得以計算出人工酶(復合物3)與對照催化劑(復合物2)的產氫轉化數(TON),從而客觀比較其催化效率。Unisense氫氣微電極在本研究中作為核心檢測設備,提供了關鍵的動力學與定量數據,直接支撐了人工酶產氫功能的驗證與性能評估,是連接分子設計與催化功能表征的重要技術橋梁。
 相關新聞
相關新聞