熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
摘要
含有硫化氫(H?S)的低氧水體的風生上升流有時會導致棲息于沿海區域的水生生物大規模死亡,包括耐低氧的菲律賓蛤仔(Ruditapes philippinarum)。我們在受控實驗室條件下檢驗了菲律賓蛤仔對H?S的耐受性。通過人工授精或從野生種群獲得的幼蟲和稚貝被暴露于常氧水、或含有或不含未電離H?S(濃度范圍0.2-52.2 mg/L)的低氧水中。24小時暴露實驗揭示了蛤仔對H?S暴露耐受性的個體發育變化:耐受性從幼蟲階段到剛附著后的稚貝階段增強,但隨著稚貝的生長而減弱。幼蟲和稚貝對H?S暴露的耐受性隨著水溫從20°C升高到28°C而減弱。延長至48小時的H?S暴露減弱了稚貝對H?S的耐受性。通過24小時再氧化的方式暫時停止H?S暴露,提高了稚貝承受重復H?S暴露的能力。
1.引言
底層低氧(溶解氧,DO≤2 mg/L)通常發生在世界范圍內的富營養化沿海區域。過量的營養鹽負荷增強了初級生產,導致有機質在海底的沉積增加。在有機質微生物分解過程中對氧氣的需求常常超過從表層補充的氧氣,特別是在夏季存在水溫或密度分層的水體條件下。這些情況經常導致底層水體形成低氧。大量研究調查了低氧對海洋底棲生物的不利影響,包括對生長、代謝、繁殖和發育的影響,以及底棲種群或群落的大規模死亡。
硫化氫(H?S)是在缺氧條件下通過硫酸鹽還原產生的。H?S通過抑制呼吸酶細胞色素c氧化酶對水生生物具有高毒性。含有H?S的低氧水體的風生上升流(稱為藍潮;Furukawa,2015)有時會導致棲息于淺水和潮灘區域的水生生物大規模死亡。例如,盡管菲律賓蛤仔對低氧具有相對較高的耐受性,但在這些災難性的上升流事件之后,有時仍會發生該蛤仔的大規模死亡:2010年東京灣北部因含有H?S的低氧水上升流導致4750噸菲律賓蛤仔死亡,2008年三河灣六條潮灘同樣有5000噸蛤仔死亡。然而,在其他含有H?S的低氧水上升流事件中,并未觀察到菲律賓蛤仔死亡:例如,在2004年至2011年間的五次藍潮事件中,有兩次未觀察到蛤仔死亡。這些野外觀察暗示存在導致該蛤仔大規模死亡的H?S水平閾值。
大量研究調查了低氧條件下硫化物對沿海區域底棲生物(包括菲律賓蛤仔)的不利影響,但毒性評估大多基于總硫化物(TS)濃度。TS包括溶解性硫化物(未電離H?S、硫氫根離子[HS?]和硫離子[S2?])和酸揮發性硫化物(如馬基諾礦/磁黃鐵礦[FeS]、四方硫鐵礦[Fe?S?]和其他金屬的無定形單硫化物)。然而,除了未電離的H?S之外的其他硫化物對水生生物沒有表現出關鍵毒性。為了更好地理解H?S對生物的毒性,需要僅檢測H?S的濃度——排除其他硫化物種類。近年來,電流型微傳感技術的發展使得能夠直接測量水生環境中未電離H?S的濃度。在此,我們使用H?S微傳感器在受控實驗室條件下檢驗了菲律賓蛤仔早期生活階段致死的H?S水平。
菲律賓蛤仔是研究低氧和H?S暴露效應的合適模型物種,原因如下:它是富營養化沿海區域底棲動物的優勢種,也是當地商業漁業的主要目標。蛤仔在幼蟲階段是浮游的,分布在低氧頻繁發生的沿海系統的廣泛空間范圍內。菲律賓蛤仔在變態為稚貝后開始其底棲生活,這些稚貝有時會遭受上述含有H?S的低氧水上升流的影響。因此,蛤仔在其整個生活史中都可能遇到含有H?S的低氧水。它在幼蟲階段、稚貝階段及之后對低氧暴露具有相對較高的耐受性;D形幼蟲、殼頂幼蟲、完長幼蟲以及附著的稚貝和成貝,在低氧暴露開始后至少能存活2天。因此,需要通過實驗室實驗研究短期暴露于低氧和H?S的聯合效應。評估菲律賓蛤仔對低氧和H?S的耐受性,可以為保護當地生態系統建立環境標準,并幫助漁業管理者規范商業和休閑漁業的努力量,以維持可持續的種群規模。在此,我們研究了菲律賓蛤仔在幼蟲和稚貝階段對低氧和H?S的耐受性,因為底棲生物種群的補充成功通常受到早期生活階段死亡率的影響。
2.材料與方法
2.1.實驗室實驗樣本
2.1.1.親本后代
為了揭示菲律賓蛤仔早期生活階段在不同水溫和H?S濃度條件下的耐受性,我們使用通過人工授精獲得的幼蟲和稚貝進行了受控實驗室實驗。我們于2016年5月17日從當地貝類經銷商(Marue Suisan Co.Ltd.,愛知縣田原市)購買了20公斤在三河灣南部(田原市沿海;圖1)捕獲的成年菲律賓蛤仔。這些蛤仔被轉移到愛知縣漁業研究所(圖1)作為親本,以獲取用于實驗室實驗的后代。我們按照Kamohara等人(2013)的程序對親本進行人工授精,即將成年蛤仔依次浸入兩個裝滿過濾海水的養殖缸中,一個水溫為13°C,另一個為26°C,時間間隔為20分鐘。重復此過程直到蛤仔開始產卵。
從人工授精的卵中孵化了大約7000萬個擔輪幼蟲,這些幼蟲被飼養在兩個0.5噸的水箱中,水箱裝有約400升22°C的過濾海水。我們每天向每個水箱中的幼蟲投喂1.5×10?cells/mL的金色巴夫藻(Pavlova lutheri)。在每個發育階段的暴露實驗開始前,我們從兩個0.5噸的水箱中隨機抽取總共30個蛤仔測量其殼長(SL)(表1)。
| 樣本來源 | 暴露時間(h) | 發育階段 | 殼長(mm) | 個體數量 |
|---|---|---|---|---|
| 人工受精(AF) | 24 | D形幼蟲 | 0.10±0.01 | 119±17 |
| 人工受精(AF) | 24 | 殼頂幼蟲 | 0.13±0.01 | 160±33 |
| 人工受精(AF) | 24 | 殼頂至完長過渡期 | 0.17±0.02 | 63±15 |
| 人工受精(AF) | 24 | 完長幼蟲 | 0.20±0.01 | 57±11 |
| 人工受精(AF) | 24 | 稚貝 | 0.73±0.04 | 10 |
| 人工受精(AF) | 24 | 稚貝 | 2.53±0.23 | 10 |
| 人工受精(AF) | 24 | 稚貝 | 5.32±0.33 | 10 |
| 人工受精(AF) | 48 | 稚貝 | 0.84±0.03 | 10 |
| 人工受精(AF) | 間歇性 | 稚貝 | 8.93±0.31 | 10 |
| 野生種群(WP) | 24 | 稚貝 | 6.94±0.73 | 10 |
| 野生種群(WP) | 24 | 稚貝 | 11.88±0.87 | 10 |
| 野生種群(WP) | 48 | 稚貝 | 11.33±0.33 | 10 |
為了培育稚貝,所有剩余的完長幼蟲被轉移到一個聚乙烯矩形容器(尺寸100cm×80cm×20cm)中,在流水的條件下使用過濾海水飼養。水溫在20°C至28°C之間波動,反映了三河灣水溫的變化。容器底部鋪有細沙(直徑<435μm),以便稚貝可以棲息在沙質基質中。每天向稚貝投喂1.5×10?cells/mL的金色巴夫藻。
2.1.2.野生種群稚貝
為了研究野外生長的稚貝的耐受性,我們使用了2015年8月27日和2016年8月18日從三河灣東北部六條潮灘(圖1)采集的野生稚貝(殼長4.6-14.3毫米,約1齡)。這些野生稚貝被轉移到愛知縣漁業研究所,按照第2.1.1小節所述方法在流水水箱中飼養。每天投喂1.5×10?cells/mL的金色巴夫藻,直到用于實驗室實驗。在野生稚貝暴露實驗開始前,我們隨機從水箱中抽取總共30個個體測量殼長(表1)。
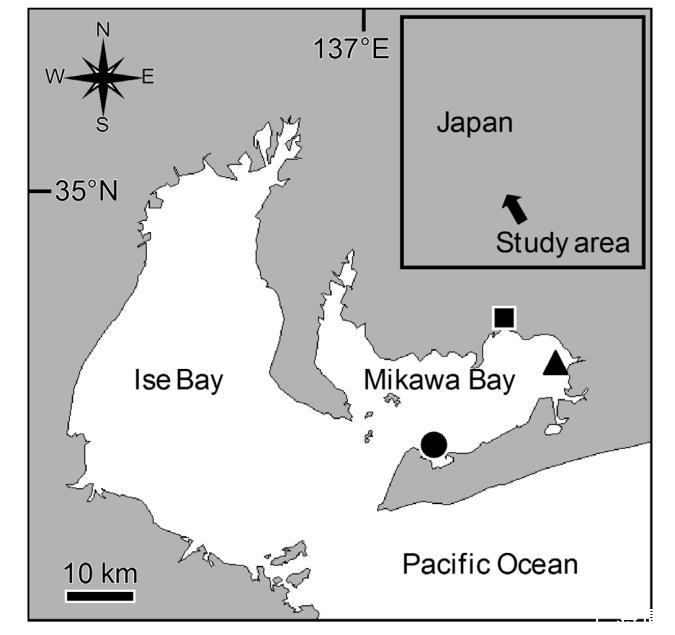
圖1. 菲律賓蛤仔(Ruditapes philippinarum)成熟個體(田原市沿海;實心圓)和稚貝(六條潮灘;實心三角形)的采樣點位置。人工授精和實驗室實驗在愛知縣漁業研究所(實心正方形)進行。
2.2.實驗系統
我們開發了一個實驗系統,用于模擬菲律賓蛤仔幼蟲和稚貝在淺海沿海區域富含硫化物的低氧水上升流期間的暴露情況。實驗系統的主要組成部分是三個密閉的實驗容器(規格見下文)、一個裝有測試溶液(常氧海水[對照],或含有或不含H?S的低氧海水)的5升燒瓶,以及一個氮氣鋼瓶(圖2)。這些組件通過PharMed管連接,以保持實驗系統的密閉性。從每個實驗容器流出的水被收集在100毫升玻璃瓶中,用于測量實驗容器中水交換剛結束時的水質(對應于暴露實驗開始)。
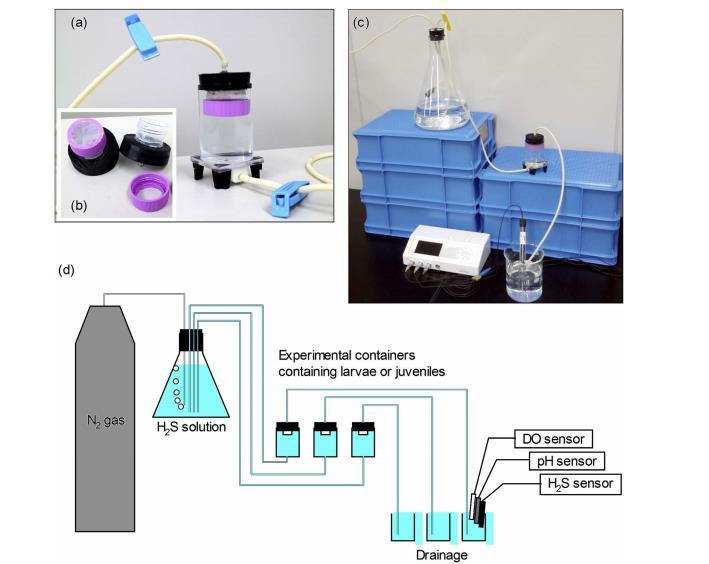
圖2. 實驗裝置圖。(a) 使用橡膠塞密封并通過PharMed管與系統連接的實驗容器。通過夾住管子停止水流,在靜態條件下進行暴露實驗。(b) 附著在橡膠塞底部的覆蓋網,用于防止幼蟲和稚貝在暴露實驗期間從密封的實驗容器中逃逸。(c) 實驗系統,包括一個盛有常氧水或含/不含H?S的低氧水的5升燒瓶。這些溶液通過虹吸效應從燒瓶經管子輸送到裝有幼蟲或稚貝的實驗容器中。每個實驗容器的排水被收集在燒杯中。圖中亦顯示了Unisense硫化氫(H?S)微傳感器。(d) 實驗系統示意圖。實驗容器中的水質通過測試燒杯中的水(在實驗開始時,即水交換剛結束后)或直接測試實驗容器中的水(在實驗結束時)使用溶解氧(DO)、pH和H?S傳感器進行測量。
圖2a顯示了用于在暴露實驗期間容納幼蟲或稚貝的實驗容器。一個丙烯酸管(長7.4厘米,內徑5.0厘米,外徑5.4厘米)的底部用一個方形丙烯酸板(5.4厘米×5.4厘米,厚5毫米)密封。一根玻璃管(長5厘米,內徑0.3厘米,外徑0.5厘米)連接到方形丙烯酸板中心的孔上。玻璃管在方形丙烯酸板下方1厘米處彎曲成90°。為了保護彎曲的玻璃管在處理過程中不受損壞,它被一個塑料盒(長1.5厘米×寬2.0厘米×高1.5厘米)覆蓋,該盒子也固定在方形丙烯酸板上。橡膠支腳(長1.5厘米×寬1.5厘米×高2.0厘米)附著在丙烯酸板的每個邊緣以支撐實驗容器。我們使用一個橡膠塞(上直徑5.4厘米×下直徑4.9厘米,高2厘米)來密封容器的上開口。
為了防止幼蟲和稚貝在實驗期間從密閉的實驗容器中逃逸,我們在橡膠塞的底部附上了一個覆蓋網(圖2b)。將一個50毫升離心管在其開口下方1.6厘米處橫向切割,并將切割下來的頂部部分粘在橡膠塞的底部。我們在離心管的蓋子上切了一個圓孔(直徑0.25厘米),并附上一個浮游生物網(網目尺寸120μm)覆蓋該孔。然后,將帶有浮游生物網的穿孔蓋子固定在離心管上。
 相關新聞
相關新聞