熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
結果
一小部分細菌基因組在部分(“孤兒”)操縱子中編碼cbb3型氧化酶亞基
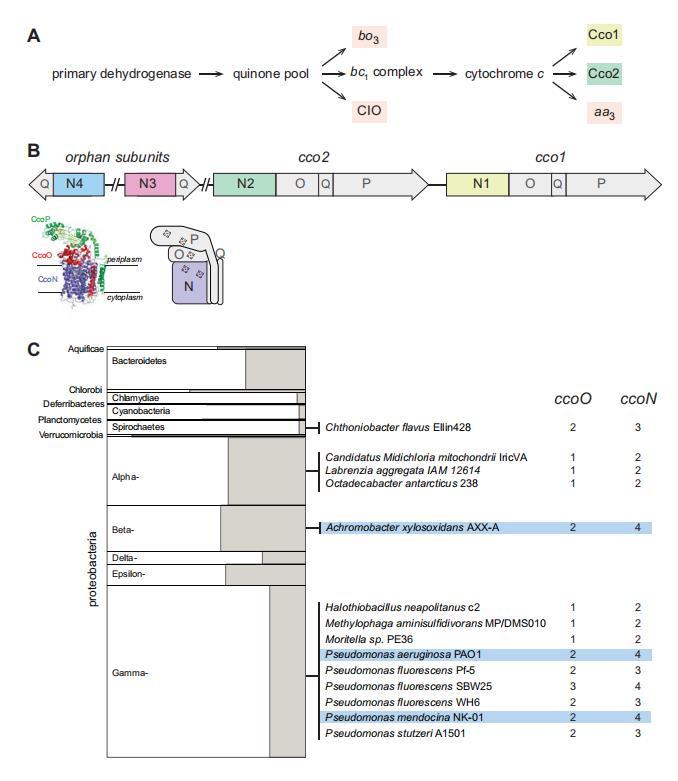
生化、遺傳和基因組分析表明,通常由操縱子編碼的CcoN和CcoO亞基形成cbb3型氧化酶的最小功能單元(Ducluzeau et al.,2008;de Gier et al.,1996;Zufferey et al.,1996)。CcoN是膜整合的催化亞基,包含兩個b型血紅素和一個銅離子。CcoO是膜錨定的,包含一個c型血紅素。額外的氧化還原亞基和/或參與復合物組裝的亞基,如CcoQ和CcoP,可以由相鄰基因編碼(圖1B)。ccoNO包含的簇廣泛分布于細菌域的多個門(Ducluzeau et al.,2008)。我們使用EggNOG數據庫(包含超過3000種細菌物種的代表性基因組(Huerta-Cepas et al.,2016))來獲取關于cco基因存在和頻率的概覽。在查詢的3318個細菌基因組中,我們發現467個具有完整的cco操縱子(編碼具有O和N亞基的潛在功能性cbb3型氧化酶)。其中,78個包含多于一個完整的操縱子。我們還使用EggNOG通過檢查單個基因組中ccoO和ccoN同源物的相對數量來尋找孤兒ccoN基因。我們發現了14個基因組,其中假單胞菌屬物種占比過高,它們包含孤兒ccoN基因(圖1C),我們的分析產生了三個包含不止一個孤兒ccoN基因的物種:門多薩假單胞菌(Pseudomonas mendocina)、銅綠假單胞菌(Pseudomonas aeruginosa)和木糖氧化無色桿菌(Achromobacter xylosoxidans)。門多薩假單胞菌是一種土壤細菌和偶發的醫院病原體,基于16S rRNA基因序列比較(Anzai et al.,2000)與銅綠假單胞菌密切相關。相反,木糖氧化無色桿菌屬于一個不同的變形菌綱,但盡管如此,它經常被誤認為是銅綠假單胞菌(Saiman et al.,2001)。與銅綠假單胞菌類似,它是一種機會性病原體,可在免疫功能低下個體和囊性纖維化患者中引起肺部感染(De Baets et al.,2007;Firmida et al.,2016)。Hirai等人先前報道了基于ClustalW對假單胞菌屬CcoN同源物的分析,表明在EggNOG數據庫中未代表的額外物種中也存在孤兒基因。這些包括反硝化假單胞菌(P.denitrificans),它包含兩個孤兒基因(Hirai et al.,2016)。
含CcoN4的異源復合物對形態發生和呼吸作用具有生物膜特異性貢獻
在生物膜中生長期間,細胞群體會遇到不同的電子供體和受體可用性條件,這與其在充分混合的液體培養物中遇到的條件不同。我們因此使用菌落形態分析研究了單個cco基因和基因簇對銅綠假單胞菌PA14生物膜發育的貢獻,該分析已證明對電子受體可用性和利用具有敏感性(Dietrich et al.,2013)。由于Cco1和Cco2復合物是銅綠假單胞菌在充分通氣和O2限制的液體培養物中生長最重要的細胞色素氧化酶(Alvarez-Ortega and Harwood,2007;Arai et al.,2014),我們預測使Cco1和Cco2功能失活的突變會影響菌落生長。確實,缺乏cco1和cco2操縱子的突變體(‘Acco1cco2’)產生了比野生型更薄的生物膜,直徑更小。發育5天后,該突變體表現出顯著的表型,包括一個高大的中央環狀結構,周圍環繞著向外輻射的短脊(圖2A,圖2-圖補充1A)。Dcco1cco2菌落顏色也更深,表明吸收剛果紅染料增加,該染料與生物膜產生的胞外基質結合(Friedman and Kolter,2004)。令人驚訝的是,特異性缺失Cco1和Cco2催化亞基的菌株(‘ΔN1ΔN2’),雖然在液體培養中顯示出與Acco1cco2相似的生長缺陷(圖2C),但在生物膜發育方面與野生型相似(圖2A,圖2-圖補充1A)。

圖2含CcoN4的異質復合體對生物膜的形態發生和呼吸有特異性貢獻。(A)上層:PA14 WT和cco突變株五天大的菌落生物膜。生物膜形態代表10個以上的生物重復。圖像使用數碼顯微鏡生成。比例尺為1厘米。下層:上圖所示生物膜的三維表面圖像。圖像使用廣域三維測量系統生成。高度刻度線:從底部(藍色)到頂部(紅色),WT、ΔN1ΔN2和ΔN4為0-0.7;ΔN1ΔN2ΔN4和Δcco1cco2為0-1.5毫米。(B)WT和cco突變體菌落生長1天后的TTC還原。還原時,TTC發生不可逆的顏色變化,從無色變為紅色。條形圖代表單獨繪制的生物重復(n=5)的平均值,誤差條代表標準偏差。(C)PA14 WT和cco突變株在含20mM琥珀酸的MOPS定義培養基中的平均生長情況。誤差條代表生物三重復的標準偏差。
由于已知在銅綠假單胞菌PAO1中,CcoN3和CcoN4可以與Cco1和Cco2氧化酶的亞基形成功能性復合物(Hirai et al.,2016),這使我們假設含有孤兒亞基CcoN3和/或CcoN4的Cco異構體可以在生物膜背景下替代Cco1和Cco2。刪除ccoN3(‘△N3’或‘△N1AN2AN3’)在突變體與相應親本菌株比較時未觀察到對生物膜發育的影響(圖2-圖補充1A)。然而,‘△N1△N2△N4’突變體的表型符合我們的模型,因為它在液體培養和生物膜生長中都模擬了Acco1cco2突變體(圖2A和C,圖2-圖補充1A)。此外,我們發現僅缺失ccoN4的突變體(‘△N4’)顯示出改變的表型,即它比野生型更早開始形成皺紋結構(圖2-圖補充1A),最終發展成一個中央環內皺紋無序區域,周圍環繞著長而向外輻射的脊(圖2A)。將ccoN4基因重新引入這些菌株中的任何一個都恢復了相應親本菌株的表型(圖2-圖補充1A)。在△N4背景下刪除ccoN2或ccoN3都沒有加劇僅在△N4中觀察到的菌落表型。然而,‘ΔN1ΔN4’雙突變體顯示出相對于△N4和△N1AN2AN4的中間表型(圖2-圖補充1B),表明CcoN1和CcoN4存在一定的功能冗余。△N4菌落的發育模式讓人聯想到吩嗪生產和感應缺陷突變體的模式(圖2-圖補充1A)(Dietrich et al.,2008;2013;Sakhtah et al.,2016;Okegbe et al.,2017)。盡管△N4本身在菌落形態分析中顯示出獨特的表型,但其在振蕩液體培養物中的生長與野生型無法區分(圖2C)。最后,刪除三種非cbb3型末端氧化酶(‘AcoxAcyoAcio’)并未影響生物膜形態(圖2-圖補充2C)。這些結果表明,含CcoN4的Cco異構體可能在生物膜中發揮特定的生理作用。
接下來,我們詢問CcoN4是否有助于生物膜中的呼吸作用。我們測試了一系列cco突變體對氯化三苯基四氮唑(TTC)的還原能力,該活性與細胞色素c氧化酶依賴性呼吸相關(Rich et al.,2001)。Acco1cco2突變體在TTC還原方面表現出嚴重缺陷,ΔN1ΔN2ΔN4突變體重現了這一缺陷。與菌落形態分析一樣,僅缺失CcoN1和CcoN2的突變體并未重現這種極端表型,表明CcoN4有助于PA14生物膜中的呼吸活性。雖然我們在△N4突變體中沒有檢測到TTC還原缺陷,但我們觀察到ΔN1ΔN4的TTC還原水平介于ΔN1ΔN2和ΔN1ΔN2ΔN4之間,進一步表明CcoN4亞基參與此活性(圖2B)。
最近的一項研究證明了CcoN4在抵抗氰化物中的作用,氰化物是銅綠假單胞菌產生的一種呼吸毒素(Hirai et al.,2016)。因此,ΔN4突變體改變的生物膜表型可能歸因于其在生物膜生長期間對產生的氰化物敏感性增加。我們刪除了hcn操縱子(編碼氰化物生物合成酶),在野生型、吩嗪缺失(Aphz)和各種cco突變體背景下進行了測試。這些菌株的生物膜形態和液體培養生長不受△hcnABC突變的影響,表明本研究中探索的CcoN4的生物膜特異性作用與其在介導氰化物抗性中的作用無關(圖2-圖補充2)。此外,我們檢查了假單胞菌基因組數據庫中可用的基因組中編碼CcoN亞基(ccoN基因)和氰化物合成酶(hcnABC)(Winsor et al.,2016)的同源物存在情況,并未發現hcnABC和ccoN4同源物之間存在明確的相關性(圖2-圖補充3)。
總之,我們在菌落形態發生和TTC還原分析中觀察到的cco基因突變效應表明,一種或多種含CcoN4的Cco異構體支持呼吸作用和氧化還原平衡,并且在生物膜中,與含CcoN1和CcoN2的Cco復合物相比,其優先被利用。我們對PA14基因組編碼的CcoN亞基進行了序列比對,并鑒定了CcoN4特有或CcoN4與CcoN1(在我們的分析中顯示出與CcoN4最強的功能冗余)共有的獨特殘基(圖2-圖補充4A)。我們還利用施氏假單胞菌CcoN亞基的可用結構(Buschmann et al.,2010)對CcoN4序列進行了穿線法建模,并高亮了這些殘基(圖2-圖補充4B)。值得注意的是,大多數高亮的殘基暴露在表面,特別是在預測的CcoN4結構的一半上,它們可能在那里結合未知的蛋白質伴侶或特定脂質。相反,被描述為與CcoO和CcoP相互作用的位點大部分是保守的,進一步支持了CcoN4可以在Cco復合物中與這些亞基相互作用的觀點。
 相關新聞
相關新聞