熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
競爭性試驗
熒光菌株(表達YFP)和非熒光菌株的隔夜預培養物在LB中按1:100稀釋(ΔN1ΔN2、ΔN1ΔN2ΔN4和Δcco1cco2按1:50稀釋),并培養至生長中期(500nm時的OD值為0.5)。用Spectronic 20D+分光光度計(Thermo Fisher Scientific)讀取500nm處的精確OD值,并將培養物調整至相同的OD值。然后將調整后的培養物按熒光與非熒光細胞1:1的比例混合,并將10毫升混合物點在菌落形態板上,按上述方法培養3天。在指定時間點收集生物膜,將其懸浮在1毫升1%的胰蛋白胨中,并在珠磨式勻漿器的"高"設置下進行勻漿;第1天的菌落勻漿35秒,第2天和第3天的菌落勻漿99秒。勻漿后的細胞被連續稀釋,10-6、10-7和10-8稀釋液被接種到1%的胰蛋白胨平板上,并在37℃下生長過夜。用TyphoonFLA7000熒光掃描儀對平板成像,確定熒光菌落數,并確定熒光菌落與非熒光菌落的百分比。
構建末端氧化酶報告程序
使用表1所列引物構建了Cco1、Cco2和CcoN4Q4操作子的轉譯報告構建體。使用相應的引物擴增啟動子區域(感興趣的操作子上游500bp),在啟動子的5'端添加一個SpeI消化位點,在啟動子的3'端添加一個XhoI消化位點。純化的PCR產物經消化后連接到pLD2722載體的多克隆位點(MCS),即gfp序列的上游。質粒被轉化到大腸桿菌菌株UQ950中,通過測序進行驗證,并通過與大腸桿菌菌株S17-1的雙親共軛轉移到PA14中。PA14單重組子在含100mg/ml慶大霉素的M9最小培養基瓊脂平板(47.8mM Na2HPO4·7H2O、22mM KH2PO4、8.6mM NaCl、18.6mM NH4Cl、1mM MgSO4、0.1mM CaCl2、20mM檸檬酸鈉二水合物、1.5%瓊脂)上進行篩選。通過引入pFLP2質粒,利用Flp-FRT重組技術從PA14中分離出質粒骨架,并在含有300毫克/毫升羧芐青霉素的M9最小培養基瓊脂平板上進行篩選,然后在不含NaCl并改良為含10%蔗糖的LB瓊脂平板上進行篩選。最終克隆中gfp的存在通過PCR進行了確認。
薄層切片分析
將兩層含1%瓊脂的1%胰蛋白胨分別倒入4.5毫米(下)和1.5毫米(上)深處。過夜前培養物在LB中以1:100稀釋(ΔN1ΔN2、ΔN1ΔN4、ΔN1ΔN2ΔN4、Δcco1cco2以1:50稀釋)并生長2小時,直至指數期早中期。然后將5至10毫升亞培養物點在瓊脂表層,將菌落置于25℃黑暗培養條件下,濕度大于90%(PercivalCU-22L),最多培養3天。在指定的時間點,將菌落覆蓋在1.5毫米厚的1%瓊脂層上,準備進行薄片切片。將夾在兩層1.5毫米瓊脂層之間的菌落從底層取出,在50mML-賴氨酸磷酸鹽緩沖鹽水(PBS)(pH7.4)中浸泡4小時(4℃),然后在4%多聚甲醛、50mML-賴氨酸磷酸鹽緩沖鹽水(PBS)(pH7.4)中固定4小時(4℃),再在37℃下過夜。固定的菌落用PBS沖洗兩次,并通過一系列乙醇清洗(25%、50%、70%、95%、3100%乙醇)脫水,每次60分鐘。菌落在Histoclear-II中孵育三次,每次60分鐘,然后在55℃下用100%Paraplast Xtra石蠟分別洗滌兩次,每次2小時,用蠟浸潤菌落,然后讓菌落在4℃下聚合過夜。使用STP120組織處理器進行組織處理。使用自動顯微切片機將修剪好的組織塊切成垂直于菌落平面的10米厚切片,漂浮在45℃的水面上,然后收集到載玻片上。將載玻片風干過夜,在45℃的電熱板上熱固定1小時,然后按相反的處理順序重新水化。將復水后的菌落立即裝入TRIS緩沖DAPI:Fluorogel中,并蓋上蓋玻片。使用LSM700共聚焦顯微鏡拍攝微分干涉對比(DIC)和熒光共聚焦圖像。每個菌株都以這種方式制備了至少三份生物樣本。
菌落厚度測量
按上述方法制備菌落薄片,但在生長培養基中添加40毫克/毫升剛果紅染料和20毫克/毫升庫馬西藍染料。利用Fiji圖像處理軟件從共聚焦DIC圖像中獲得菌落高度測量值。
凝集素染色
按上述方法制備兩天大的菌落進行薄片切片。將復水后的菌落用100mg/ml熒光素標記的紫藤凝集素(VectorLaboratories(Burlingame,CA)FL-1351)在PBS中染色,然后用PBS沖洗兩次,用TRIS緩沖的DAPI裝片并覆蓋蓋玻片。使用LSM700共聚焦顯微鏡(Zeiss)拍攝熒光共聚焦圖像。
生物膜的氧化還原分析
使用25μm尖端的氧化還原微電極和外部參比電極(Unisense RD-25和REF-RM)來測量第2天(約48小時)生物膜(與菌落生物膜形態測定一樣)的細胞外氧化還原狀態。氧化還原微電極測量的是樣品相對于參比電極吸收或釋放電子的趨勢,參比電極與樣品生長在相同的介質中。氧化還原微電極根據制造商的說明進行校準,采用pH4緩沖液中1%喹啉酮和pH7緩沖液中1%喹啉酮的兩點校準法。使用微機械手(Unisense)在整個生物膜深度每隔5μm測量一次氧化還原,測量時間為3秒,兩次測量之間的等待時間為5秒。使用萬用表(Unisense)和Sensor Trace曲線軟件(Unisense)記錄曲線。
生物膜的氧剖面分析
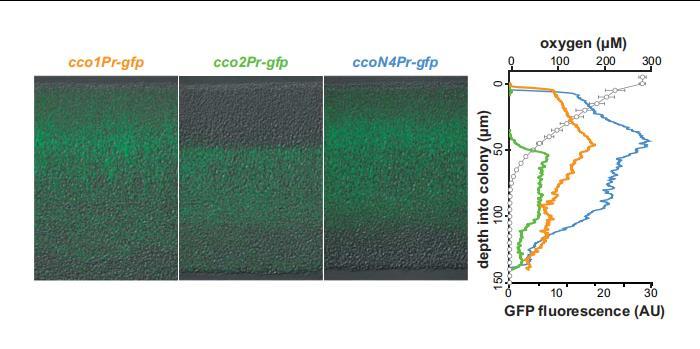
使用25μm尖端的氧微量傳感器(Unisense OX-25)測量生物膜生長頭2天內的氧濃度。在對生長3天的菌落進行氧氣分析時(圖4),生物膜的生長過程與薄片分析相同。為了校準氧氣微電極,使用了兩點校準法。首先使用校準室(Unisense CAL300)將氧微傳感器校準為大氣中的氧氣,校準室中裝有持續冒著氣泡的水。然后,使用充入N2的缺氧水溶液將微傳感器校準到"零"點;為確保完全去除所有氧氣,在將微傳感器校準到零校準點之前,向校準室充入N2至少30分鐘。然后在生物膜的整個深度進行氧氣測量,測量時間為3秒,兩次測量之間的等待時間為5秒。對于6個生長期的菌落,整個菌落的剖面步長為1μm;對于12小時和24小時的菌落,步長為2μm;對于48小時的菌落,步長為5μm。使用微型機械手(Unisense MM33)在生物膜內移動微型傳感器,并使用萬用表(Unisense)和Sensor Trace曲線軟件(Unisense)記錄曲線。
吩嗪定量
將過夜的預培養物以1:10的比例在LB中稀釋,然后點在一個25毫米的過濾盤上(孔徑:0.2μm),過濾盤放置在一個35×10毫米的圓形培養皿中央。菌落在濕度大于90%的25℃黑暗環境中生長2天。生長2天后,將每個菌落(連同過濾盤)從各自的培養皿中取出并稱重。然后在5毫升100%甲醇中過夜提取瓊脂培養基中排出的酚嗪類類化合物(在黑暗中,室溫下進行)。然后用0.22μm纖維素Spin-X柱過濾300μl過夜酚嗪類/甲醇提取液,并將200μl流出液裝入高效液相色譜瓶。如前所述,使用高效液相色譜法(Agilent 1100 HPLC系統)對酚嗪類類化合物進行定量。
線蟲致病性(慢殺)試驗
慢速殺滅試驗按前述方法進行。簡單地說,將10μl過夜PA14培養物(如上所述生長)點到慢殺瓊脂平板上(0.3%NaCl、0.35%Bacto-Peptone、1mM CaCl2、1mM MgSO4、5mg/ml膽固醇、25mM KPO4、50mg/ml FUDR、1.7%瓊脂),平板在37℃下培養24小時,然后在室溫(~23℃)下培養48小時。將幼蟲期4(L4)的線蟲挑到PA14種子平板上,并對活蟲/死蟲進行長達四天的計數。每個平板被視為一個生物重復,起始樣本量為30-35條線蟲。
 相關新聞
相關新聞