熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
研究簡介:乳腺癌是全球最常見的癌癥之一,其治療手段包括手術、放療和系統化療等。然而乳腺癌的預后仍面臨挑戰,尤其是對于發生轉移的患者。乳腺癌組織抵御細胞內酸化的機制依賴于通過鈉碳酸氫鹽共轉運蛋白NBCn1/Slc4a7和鈉氫交換蛋白NHE1/Slc9a1的凈酸排泄。NBCn1作為一種乳腺癌易感性蛋白和潛在的治療靶點逐漸受到關注,而針對NHE1的靶向治療效果尚不明確。目前已有針對NHE1的選擇性小分子抑制劑,但針對NBCn1的抑制劑尚未出現。細胞實驗結果表明,NHE1的活性與細胞增殖、遷移和侵襲相關,且NHE1表達的破壞可減少三陰性乳腺癌的生長。然而在人類乳腺癌組織中,高NHE1表達與降低的轉移風險以及某些分子亞型中改善的患者生存率相關。研究人員通過三種不同的給藥方式(飲水、滲透泵和腫瘤內/周圍注射)對小鼠進行卡里柏利處理,以評估其對腫瘤生長的影響。實驗測量了腫瘤體積、細胞內pH(pHi)、凈酸排泄以及血清和組織間質中的代謝物水平等指標。本研究探討了卡里柏利(Cariporide)對ErbB2驅動的乳腺癌生長的影響。卡里柏利是一種選擇性鈉氫交換蛋白1(NHE1)抑制劑,已知NHE1在乳腺癌細胞的酸化防御中起關鍵作用。研究使用FVB/N-Tg(MMTVneu)202Mul/J小鼠模型,該模型通過在乳腺上皮中過表達ErbB2來模擬人類乳腺癌的發生和發展。
Unisense微電極系統的應用
Unisense微電極被用于測量小鼠乳腺腫瘤組織的pH值。小鼠通過腹腔注射麻醉劑(如氯胺酮和甲苯噻嗪)進行麻醉,并放置在加熱墊上以保持體溫。通過小切口暴露腫瘤組織,將微電極安裝在微操縱器上,微電極的參考電極放置在腹腔內。微電極以1毫米的步進逐漸插入腫瘤組織,記錄每個位置的pH值。測試到腫瘤組織中最酸性位置的pH值。Unisense微電極精確測量了腫瘤組織內部的pH值,對于理解腫瘤微環境的酸堿狀態至關重要。腫瘤微環境的酸堿狀態與腫瘤的生長、侵襲和對治療的反應密切相關。
實驗結論
卡里柏利在體外能有效抑制乳腺癌組織的凈酸排泄,但對穩態細胞內pH(pHi)的影響較小。長期體內給藥卡里柏利通過上調鈉碳酸氫鹽共轉運蛋白NBCn1的表達進行補償,使pH調節更多地依賴于二氧化碳/碳酸氫鹽(CO?/HCO??)機制,因此對ErbB2驅動的乳腺癌生長沒有明顯的影響。卡里柏利在體外能有效抑制乳腺癌組織的凈酸排泄并輕微降低細胞內pH,但在體內長期使用時,由于NBCn1的上調和pHi調節機制的改變,卡里柏利對ErbB2驅動的乳腺癌生長沒有顯著影響。這一發現表明,盡管NHE1是一個有前景的治療靶點,但在實際應用中可能需要考慮其他補償機制的影響。研究結果為NHE1抑制劑在乳腺癌治療中的潛在應用提供了重要見解,并強調了在體內環境中評估藥物效果的復雜性。
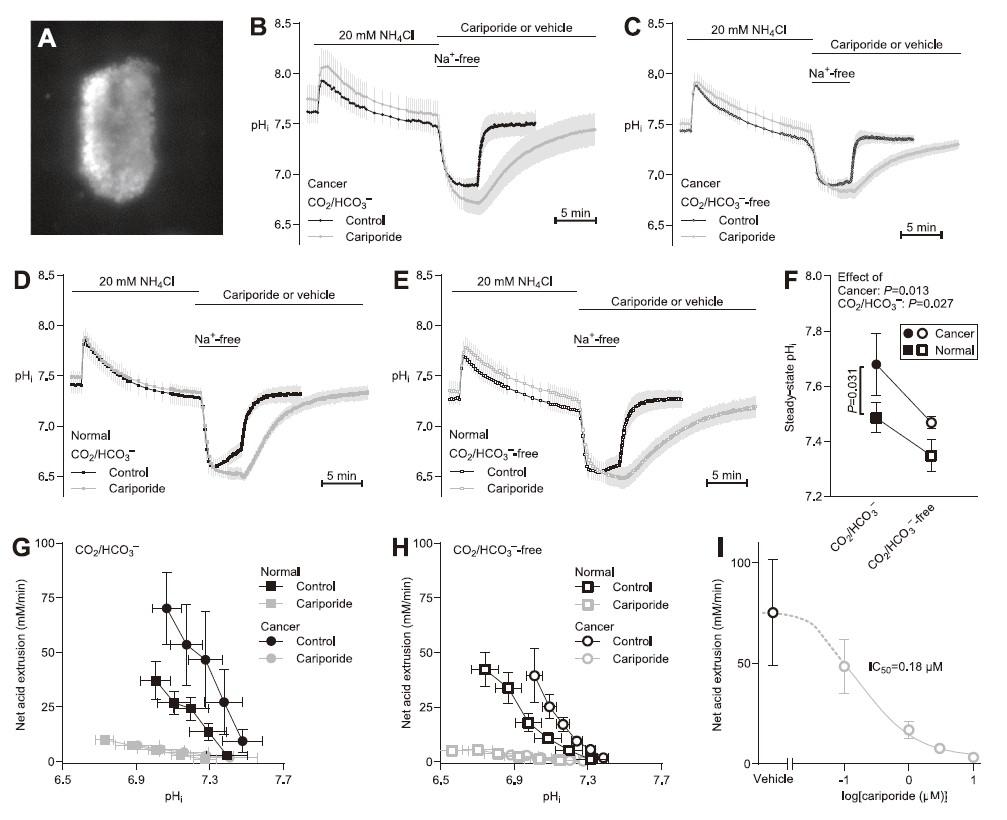
圖1、卡里柏利抑制乳腺癌組織的凈酸擠出,IC為0.18μM。A.從乳腺癌組織中分離并加載pH敏感熒光團BCECF的原代類器官的圖像。B-E.在NH預脈沖實驗期間從初級類器官測量的pH值的平均痕量(n=5-8)。卡里柏利以10μM施用。F.從乳腺癌組織和正常乳腺組織中急性分離的原代類器官的靜息穩態pH,并在存在和不存在CO/HCO的情況下進行評估(n=7-8)。通過雙向方差分析比較數據,然后進行ˇSíd'ak后測試。G,H.凈酸擠出活性繪制為pH值的函數(n=7-8)。卡里柏利濃度為10μM。比較了基于最小二乘線性回歸分析計算的曲線的截距和斜率。當暴露于不同濃度的卡立波利時,在沒有CO/HCO的情況下,NH前脈沖誘導的酸化后,原發性乳腺癌類器官在平均pH值為6.8時評估的凈酸擠出(n=7-9)。
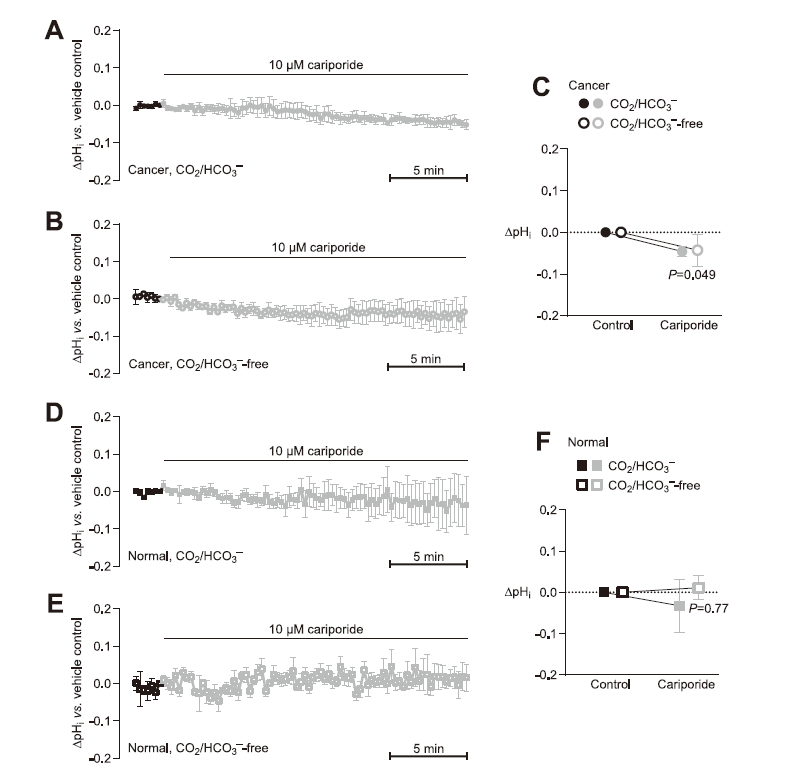
圖2、Cariporide略微降低乳腺癌組織中的穩態pH。A、B、D、E.從乳腺癌組織(A,B)或正常乳腺組織(D,E)中急性分離的pHin原代類器官的平均痕量。在存在(A,D)或不存在(B,E)CO/HCO的情況下施用卡立泊利(10μM),我們報告了與匹配的載體/時間對照(n=4)相比的pH值差異。C,F.在存在和不存在CO/HCO(n=4)的情況下,研究了從乳腺癌組織(C)和正常乳腺組織(F)分離的原代類器官中對10μM卡立泊利應用的pH反應,并相對于匹配的載體/時間對照進行了報告
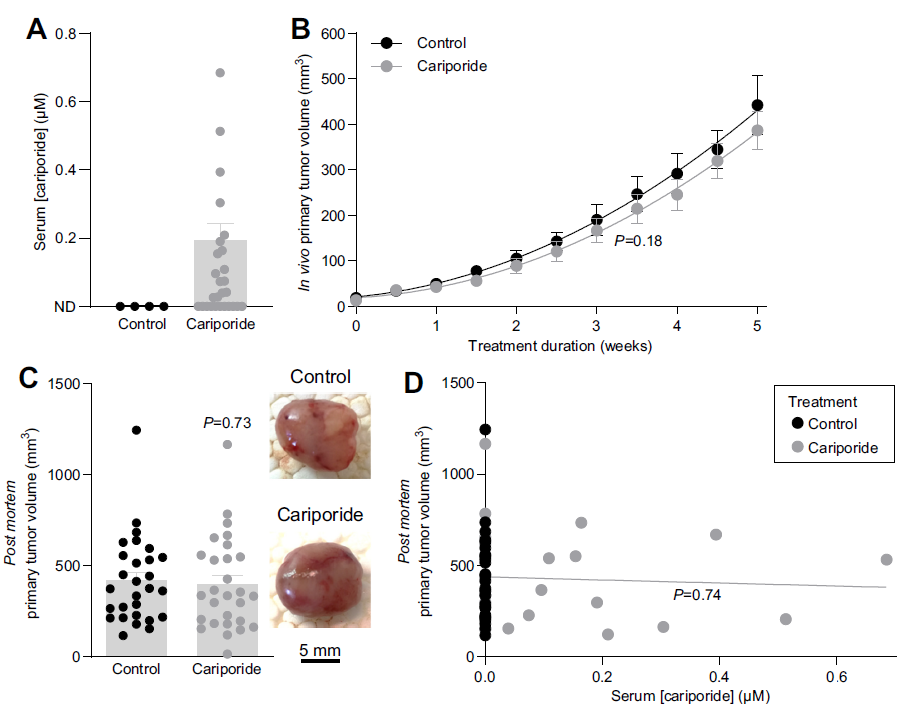
圖3、飲用水中提供的卡立泊利不會影響原發性乳腺癌的生長。A)在接受常規或含卡泊利的飲用水的小鼠的血清中測量的卡立泊利濃度。測試了來自4只對照小鼠(以確認測定特異性)和27只卡立泊利處理的小鼠的隨機樣本的血清。ND,檢測不到。B)體內腫瘤體積測量(n=28)。顯示最佳二階多項式函數,并通過額外的平方和F檢驗進行比較;P值與對照。C)死后腫瘤切除后的離體腫瘤體積測量(n=28)。通過未配對的雙尾學生t檢驗比較數據;P值與對照。D)圖C的離體腫瘤體積繪制為相應測量的血清卡里泊利濃度的函數。
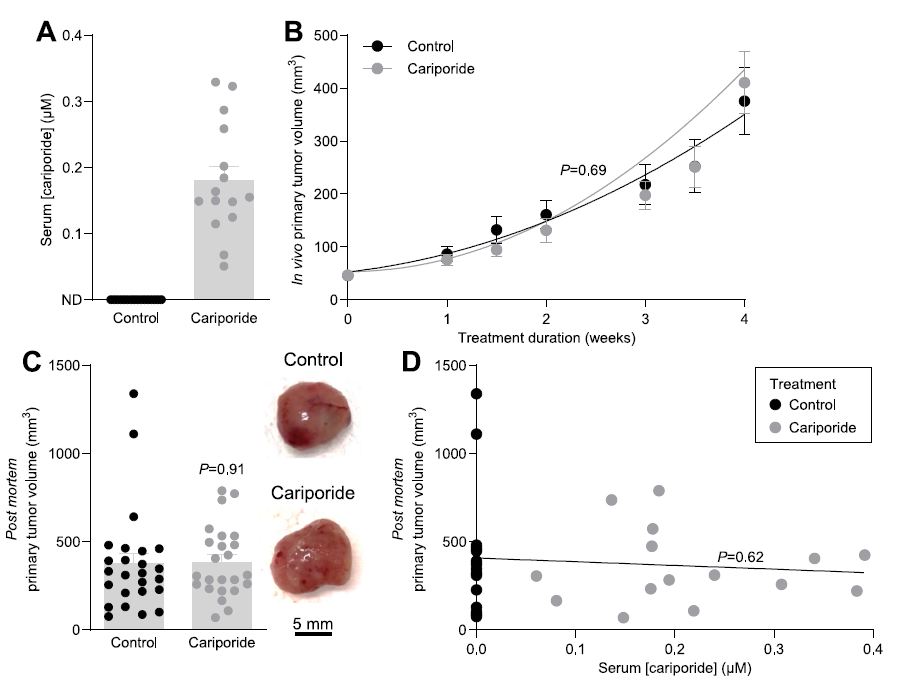
圖4、通過滲透微型泵供應的卡立泊利不會影響原發性乳腺癌的生長。A)通過滲透微型泵(n=15-16)接受卡立波利或NaCl載體的小鼠血清中測量的卡立泊利濃度。ND,檢測不到。B)體內腫瘤體積測量(n=24-25)。顯示最佳二階多項式函數,并通過額外的平方和F檢驗進行比較;P值與對照。C)死后腫瘤切除后的離體腫瘤體積測量(n=24-25)。D)圖C的離體腫瘤體積繪制為圖A中相應血清卡立普利濃度的函數。通過最小二乘線性回歸分析比較數據
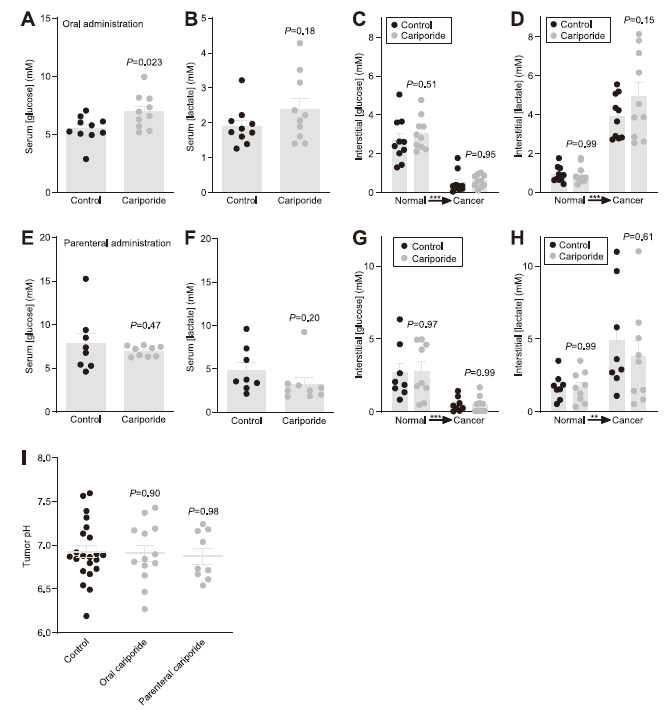
圖5、口服但非腸外給藥卡立泊利會升高血糖濃度。A、B、E、F.通過飲用水(A,B,n=10)或滲透微型泵(E,F,n=8–9)暴露于卡立泊利或載體的小鼠的血清葡萄糖(A,E,E)和乳酸(B,F)和乳酸(B,F)濃度。C、D、G、H.通過飲用水(C,D,n=10)或滲透微型泵(G,H,n=8–9)從暴露于卡立波利或載體的小鼠的乳腺癌和正常乳腺組織中通過微透析取樣測量的間質葡萄糖(C,G)和乳酸(D,H)和乳酸(D,H)濃度。I.用pH敏感微電極(n=9–22)測量體內腫瘤pH值。面板A、B、E和F中的數據通過未配對的雙尾學生t檢驗進行比較,在C、D、G和H中通過重復測量雙向方差分析后跟ˇSíd'ak后測,在圖I中通過單因素方差分析后跟Dunnett后測。P值與相同條件下的對照。
結論與展望
乳腺癌組織抵御細胞內酸化的機制依賴于通過鈉碳酸氫鹽共轉運蛋白NBCn1/Slc4a7和鈉氫交換蛋白NHE1/Slc9a1的凈酸排泄。NBCn1作為一種乳腺癌易感性蛋白和潛在的治療靶點逐漸受到關注,而針對NHE1的靶向治療效果尚不明確。目前,已有針對NHE1的選擇性小分子抑制劑,但針對NBCn1的抑制劑尚未出現。細胞實驗結果表明,NHE1的活性與細胞增殖、遷移和侵襲相關,且NHE1表達的破壞可減少三陰性乳腺癌的生長。然而,在人類乳腺癌組織中,高NHE1表達與降低的轉移風險以及某些分子亞型中改善的患者生存率相關。在此,我們評估了鈉氫交換抑制劑卡里柏利/HOE-642在ErbB2驅動的乳腺癌小鼠模型中的治療潛力。體外實驗顯示,卡里柏利可抑制乳腺癌組織的凈酸排泄(IC50=0.18μM),并導致細胞內pH(pHi)的輕微下降。在體內實驗中,研究人員通過口服、滲透泵以及腫瘤內和腫瘤周圍注射的方式給藥,以解決卡里柏利口服生物利用度低和代謝快的問題。
長期體內給藥卡里柏利可上調NBCn1表達,使pHi調節更多地依賴于二氧化碳/碳酸氫鹽機制,并且對ErbB2驅動的原發性乳腺癌的生長速率無凈影響。卡里柏利也不會影響乳腺癌組織中的增殖標志物。口服卡里柏利會使血清葡萄糖水平升高約1.5 mM,而通過其他途徑給藥則不會。卡里柏利在體外可有效抑制乳腺癌組織的凈酸排泄,但對穩態pHi的影響較小。長期體內給藥卡里柏利通過NBCn1進行補償,我們觀察到對ErbB2驅動的乳腺癌生長沒有明顯的影響。unisense氫氣微電極通過精確測量腫瘤組織內部的pH值,為評估卡里柏利對腫瘤微環境的影響提供了關鍵數據。這些數據支持了研究的主要結論,即卡里柏利在體內對ErbB2驅動的乳腺癌生長沒有顯著影響。
 相關新聞
相關新聞