熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
3.6.微生物群落和功能微生物的分布
分析了微生物群落結構,研究了ABA系統中的微生物組成。如圖所示S9,藻門包括藍藻(45.0%)和綠藻(9.8%),反映了一種藻細菌特征,即藻類構成了藻細菌生物量的大部分,支持菌落在藻球中的生長。此外,變形菌門的相對豐度為27.7%,這在處理吡啶廢水中曾被發現是最主要的門。
在屬的水平上,PBR-1中ABA系統的優勢藻類屬從最初接種的小球藻轉變為螺旋藻,這是一種典型的藍細菌。然而,經過75天后,小球藻的豐度減少到4.4%。已有報道稱,螺旋藻等藍細菌在廢水處理系統中可能會擊敗小球藻等真核微藻,這與本研究一致。此外,據報道螺旋藻可能充當核心或形成交織的墊狀結構以困住其他微生物。norank_Burkholderiales、norank_Myxococcaceae和Aquabacterium的相對豐度分別為4.5%、3.4%和3.1%。據報道,Aquabacterium是與反硝化作用相關的物種。屬于Burkholderiales目的硝化藻屬據報道能夠同時參與氨氧化和亞硝酸鹽還原。此外,Myxococcaceae可以參與硝酸鹽和亞硝酸鹽的還原,而Myxococcaceae據發現與Nitrosomonas和Nitrospiras在活性污泥中呈正相關。此外,Paracoccus(0.7%)也是ABA系統中的優勢成分之一。已發現Paracoccus能夠利用難降解的污染物作為電子供體進行反硝化。因此,螺旋藻在ABA球體結構的形成中發揮了關鍵作用,具有光合層和各種功能菌群的協同作用。

圖6 PBR-1中ABA的FISH圖像:組合圖像(a)、大部分細菌(b)、藻類(c)、反硝化細菌(d)和硝化細菌(e)。
基于上述DO和pH梯度的結果(圖2),可以推斷藻類,如小球藻和螺旋藻,位于ABA的表層。硝化細菌,如屬于Burkholderiales目的Nitrosomonas屬,以及屬于變形菌門的需氧降解吡啶的細菌(屬于變形菌門Proteobacteria門),應分布在接近藻類的地方,以利用藻類光合作用產生的溶解氧。此外,反硝化細菌,如Paracoccus和Aquabacterium,可能位于ABA的內層,那里的溶解氧水平較低。FISH分析顯示了ABA中功能微生物的空間分布。如圖6a所示,藻類(綠色)主要分布在ABA的表層,這對于進行光合作用獲得照明非常有利。然而,反硝化細菌(藍色)分布在內層,那里缺乏豐富的氧氣。圖6c-e顯示,硝化細菌(紫色)位于與藻類相同的位置,有助于通過硝化利用光合作用產生的溶解氧。
3.7轉錄組學分析和酶活性測定
3.7.1吡啶的生物降解、硝化作用和反硝化作用
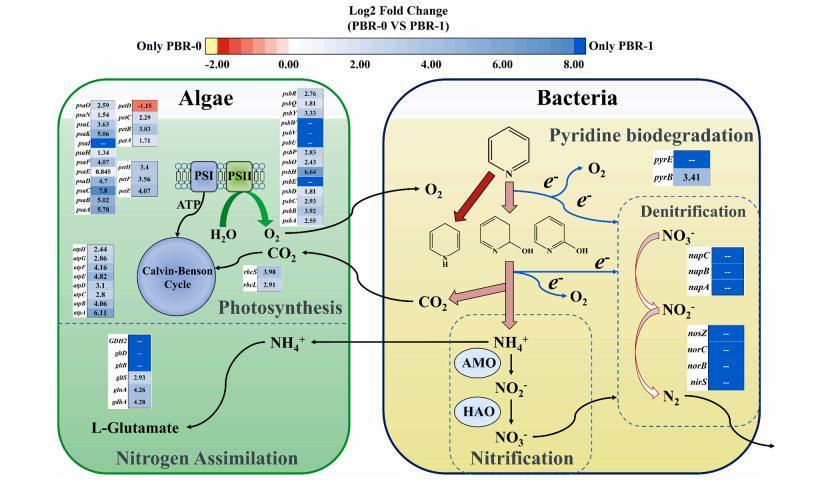
圖7 ABA系統中氮代謝和光合作用的分子調控網絡與吡啶的生物降解相配合。用基因名稱(PBR-0 vs PBR-1)的熱圖顯示了不同代謝途徑中存在差異表達的基因。光系統I;peaA-O:光系統A-D:細胞色素b6/f復合物;光合電子傳遞;光系統II;atpA-H:ATP合酶:卡爾文-本森循環(Rubisco);gdhA、glnA、gltS-D、GDH2:谷氨酰胺/谷氨酸合酶;pyrB-E:吡啶降解;napA-C:硝酸鹽還原酶、nirS、norB-Z:亞硝酸鹽還原酶/一氧化氮還原酶。所有基因的描述見表S3。
圖7顯示了ABA系統中的微生物代謝機制和基因表達。通過將預培養的藻類-細菌共生體引入活性污泥,同化、硝化和反硝化可以共存為無需添加額外碳源的氮轉移途徑。首先,通過利用O2和NO3-作為電子受體,將吡啶-N通過吡啶生物降解轉化為NH4+-N。與PBR-0相比,pyrB和pyrE編碼的吡啶降解在PBR-1中上調并且僅在PBR-1中表達,表明了更高效和多樣化的吡啶生物降解。然后,NH4+-N可以通過硝化轉化為NO2--N和NO3--N,而NO2--N和NO3--N通過異養反硝化作用轉化為N2。如圖S10所示。參與硝化-反硝化的關鍵酶,包括AMO、HAO、NAR、NIR、NOR和N2OR只存在于PBR-1中。參與反硝化酶的基因,包括napA、napB、napC、nirS、norB、norC和nosZ,僅在PBR-1中表達。相反,在PBR-0中它們沒有表達。因此,硝化-反硝化在PBR-1的ABA系統中對吡啶和氮的去除起到了關鍵作用。
3.7.2 ABA系統的同化、光合作用活性和群體感應
雖然藻-菌群引入活性污泥后,氮轉移途徑發生了顯著變化,但ABA系統可以很好地維持藻類與細菌之間的共生關系。藻類與細菌對氮源的競爭不明顯,但形成了穩定的協同除氮模式,并保持良好。如圖7所示。光合作用相關基因(e.g.,與光系統I(PSI)、光系統II(PSII)、ATP合酶、細胞色素b6/f復合物和光合電子傳遞)相關的基因在PBR-1中普遍上調。Chen等人在中認為,ROS過量藻類引起的對藻類的抑制主要與編碼PSI、PSII和電子傳遞的基因的表達降低有關,因此這些基因在PBR-1中的表達增加可能是藻類的自適應原因。此外,這些基因的表達水平也有所上調(e.g.,atpA-atpH編碼ATP合酶、rbcL和rbcS編碼二磷酸核酮糖-羧化酶為關鍵酶,gdhA、glnA、gltS-D、GDH2編碼谷氨酰胺/谷氨酸合酶)可提高二氧化碳的利用和氮的同化,這有助于增強傳質和營養去除。因此,應用藻類-菌群通過開發活性污泥系統PBR-1可能有利于藻類對環境沖擊的抵抗力。有趣的是,NR作為參與同化硝酸鹽還原的基因在PBR-1中消失,表明NH4+-N的同化是ABA系統中吸收氮的唯一途徑,而NO2--N和NO3--N不能被藻類吸收(表S3)。因此,在ABA系統中,通過同化和硝化反硝化可以有效去除氮。此外,根據QS相關基因注釋,PBR-1中除激活子外的QS活性更明顯。S11),表明上調QS相關基因的表達可能發揮了活性污泥中藻類與不同細菌之間的聚集和增強共生效應的促進作用。
3.8吡啶的生物降解和脫氮機理
基于以上結果,提出了通過硝化-反硝化共代謝過程同時提高吡啶和氮去除率的可能機制。如圖8所示,外部光照促使藻類聚集在ABA的表層,通過光合作用產生溶解氧(DO)。然后通過藻類的光合氧化在ABA表層形成了一個好氧區,適合于吡啶的好氧生物降解和硝化等好氧生物過程。硝化細菌分布在藻類周圍,通過硝化作用將吡啶釋放的NH4+-轉化為NO2--和NO3--。據報道,在傳統的ABS系統中,一些氨氧化細菌可能會被光照抑制。ABA可以提供一個陰涼的環境,在那里一些光抑制菌種,如氨氧化細菌可以躲在藻類后面。隨著好氧生物降解和表層硝化作用對DO的快速消耗,ABA內層形成了缺氧/厭氧區,反硝化細菌分布在該區。反硝化細菌可以利用包括吡啶、吡啶生物降解的中間體和藻類分泌在內的有機碳源將NO2--和NO3--轉化為N2。因此,硝化-反硝化過程可能是吡啶與吡啶生物降解釋放氮有效共代謝的原因。與其他系統不同的是,吡啶的更多產物類別表明ABA內好氧、厭氧和厭氧生物過程的共存和整合。
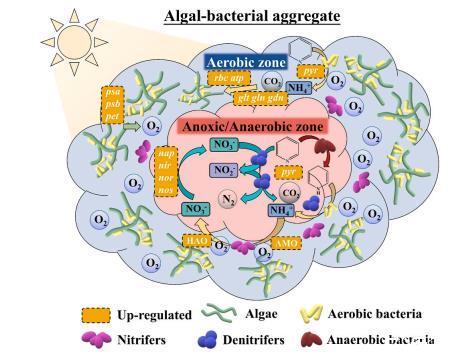
圖8 PBR-1中硝化-反硝化共代謝同時降解和脫氮的機制:ABA在有氧和缺氧/厭氧生物過程中的微環境。
4.結論
通過接種預培養的藻類-細菌共生體系到活性污泥中,構建了ABA系統,其中Limnothrix的關鍵參與以及活性污泥中存在的多樣性物種導致了ABA的形成。ABA系統中硝化-反硝化作為一種共代謝過程增強了吡啶和氮的同時去除。特別是,與傳統ABS系統相比,ABA系統中TN去除效率可保持在80%以上。從吡啶中氮的去除過程揭示了與吡啶的礦化、同化、硝化和反硝化相關的過程。在ABA中,好氧和厭氧/無氧生物過程的共存在微生物代謝和轉錄水平上得到確認。此外,ABA系統主要排放藻類-細菌生物量、O2和N2,導致溫室氣體幾乎零排放,能源消耗極低。本研究開發的ABA系統具有協同廢水回收和碳中和多功能,為同時去除含氮有機化合物和氮提供了新的思路。
環境影響
這項研究為同時去除含氮有機化合物和氮的藻類-細菌聚集體(ABA)系統提供了新的線索。ABA系統是通過將預培養的藻菌菌群接種到活性污泥中構建的。硝化-反硝化作為共代謝過程,增強了吡啶和氮的同時去除。ABA中需氧和缺氧/厭氧生物過程的共存在微生物代謝和轉錄水平上得到了證實。ABA系統主要排放藻類-細菌生物量、O2和N2,導致溫室氣體排放近乎零,能耗極低,顯示出協同廢水回收和碳中和的多重功能的巨大潛力。
附錄A。支持信息
與本文相關的補充數據可以在doi:10.1016/j.jhazmat.2023.132390.的在線版本中找到。
 相關新聞
相關新聞