熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
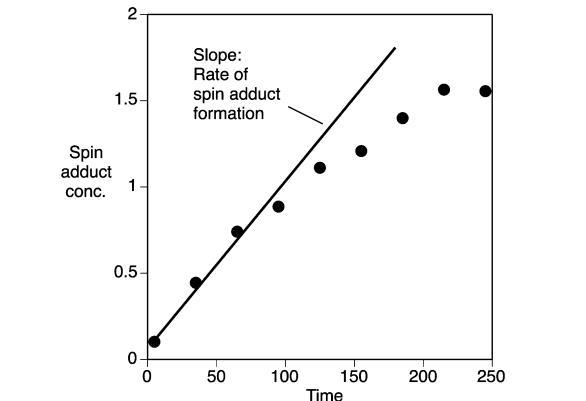
麥汁ESR強制老化測試:麥汁樣品(25.0毫升),含有5%(體積/體積)乙醇(96%純乙醇,丹麥蒸餾廠,奧爾堡,丹麥)和POBN[α-4-吡啶基-1-氧化物-N-叔丁基硝酮,Aldrich,St.Louis,MO],在密閉的藍蓋瓶(250毫升)中于室溫下攪拌10分鐘,以使反應物溶解。瓶子內有足夠的大氣空氣頂部空間。將瓶子轉移到預熱的水浴(T=55°C)(Heto Laboratory Equipment,Allerod,Denmark)中。在給定的時間間隔取出樣品(50μL)。使用Miniscope MS 200 X波段光譜儀(Magnettech,Berlin,Germany)記錄麥汁樣品的ESR光譜,使用50μL微量移液管作為樣品池(Brand GMBH,Wertheim,Germany)。使用的設置如下:微波功率,10 mW;掃描寬度,95.9 G;調制頻率,1000 mG;接收增益,900;掃描時間,60秒。所有光譜(單次掃描)均在室溫下記錄。光譜的振幅以中心雙峰的高度相對于TEMPO水溶液(2μM)ESR信號中心線的高度進行測量和報告。TEMPO標準品在當天第一個和最后一個樣品時進行測量。所有樣品均進行三次重復測量。麥汁樣品的氧化穩定性通過自旋加合物形成的初始速率來量化,該速率由在強制老化期間自旋加合物濃度初始上升階段(在自旋加合物濃度開始趨于平穩之前)的線性回歸確定(圖3)。
加熱麥汁的耗氧量:將室溫麥汁樣品轉移到4毫升測量室(MR-Chamber,Unisense,Aarhus,Denmark)中,不留空氣頂部空間。將裝滿的測量室置于預熱的水浴(T=60°C)(Heto Laboratory Equipment,Allerod,Denmark)中。測量室配備克拉克電極(Unisense NR-sensor,Aarhus,Denmark),并立即開始測量。通過氧分析儀(Picoammeter PA 2000,Unisense,Aarhus,Denmark)每10秒記錄一次氧濃度。測量前使用兩點校準(60°C空氣飽和水和60°C的0.1 M抗壞血酸鈉在0.1 M NaOH溶液中)來校準電極和氧分析儀。
添加鐵的醪液和麥汁的ESR強制老化測試:從新鮮制備的FeSO4(Merck,Darmstadt,Germany)水溶液儲備液中,將最終濃度為50μM的FeSO4添加:(i)在糖化開始時,即麥芽與水混合時,添加到醪液中;或(ii)添加到糖化和過濾后獲得的麥汁中。對糖化25分鐘和125分鐘后收集的麥汁樣品進行ESR強制老化測試。
金屬分析:使用原子吸收光譜法(Perkin-Elmer 3300,United States)測定在糖化開始25分鐘和125分鐘后收集的麥汁樣品中的Fe和Cu濃度。比較了向麥汁樣品中添加50μM FeSO4:(i)在糖化開始時添加;(ii)在糖化和過濾后添加到麥汁中;以及未添加FeSO4的對照麥汁。
過氧化氫、過氧化氫酶和超氧化物歧化酶的影響:將過氧化氫(30%,Sigma-Aldrich,Steinheim,Germany)、過氧化氫酶(E.C.1.11.1.6,來自Scytalidium thermophilum的純酶,無葡萄糖氧化酶副活性,Novozymes A/S,Bagsvaerd,Denmark)或牛超氧化物歧化酶(E.C.1.15.1.1)(Sigma-Aldrich,Steinheim,Germany)在添加乙醇和POBN之前立即添加到冷藏的麥汁樣品中,并按上述方法進行ESR強制老化實驗。一個過氧化氫酶單位(CIU)對應于在pH 7和30°C下每分鐘分解1μmol過氧化氫的酶量。CIU通過分光光度法測定,評估在30°C、50 mM磷酸鹽緩沖液(pH 7.0)中,過氧化氫酶在240 nm處去除H2O2的情況[ε=39.4 M?1cm?1],將在240 nm處吸光度從0.450(H2O2起始濃度為10.3 mM)降至0.400所需的時間(秒)轉換為每克酶產品的CIU。一個超氧化物歧化酶單位(SODU)將在偶聯系統(含黃嘌呤和黃嘌呤氧化酶)中,在pH 7.8、25°C、3.0 mL反應體積下,使用引起550 nm處吸光度變化率為0.025每分鐘的黃嘌呤氧化酶濃度,抑制細胞色素c還原速率的50%。
統計分析:使用SAS JMP 6.0.0軟件包(SAS Institute,Inc.,United States)進行統計分析。通過方差分析確定主效應的顯著性。使用最小顯著差異(LSD)檢驗識別平均值之間的顯著(p<0.05)差異。
結果
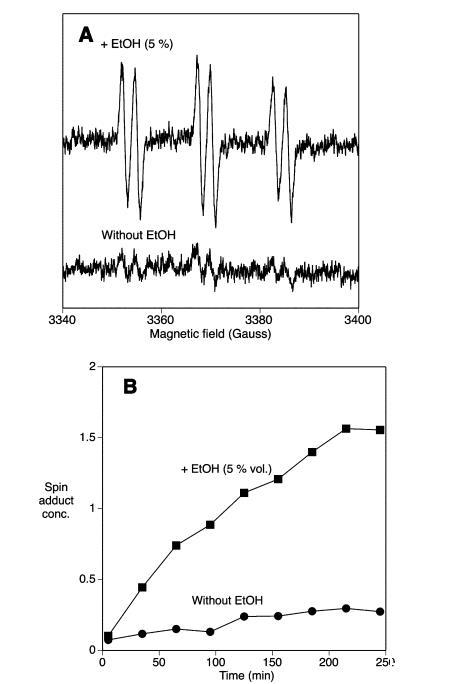
甜麥汁的氧化穩定性:麥汁的氧化穩定性通過一種基于ESR的方法進行研究,該方法類似于評估啤酒風味穩定性的既定方法。將自旋捕獲劑添加到糖化不同階段收集的麥汁中,通過ESR檢測在有空氣接觸加熱過程中形成的自旋加合物。單獨使用自旋捕獲劑POBN得到ESR可檢測的信號,這些信號隨時間增加但振幅非常低(圖2)。同時添加乙醇和自旋捕獲劑顯著增加了信號的振幅,正如Franz和Back先前所示。在乙醇存在下形成的POBN自旋加合物具有超精細耦合常數(aN=15.5 G和aH=2.5 G),與1-羥乙基自由基形成的自旋加合物的預期值相似。在無乙醇情況下形成的弱ESR信號具有非常相似的超精細耦合常數(aN=15.3 G和aH=2.6 G),這表明捕獲的是碳中心自由基。
在所有甜麥汁樣品中,自旋加合物的形成沒有初始滯后期,并且在樣品長時間加熱過程中形成的自旋加合物量趨于平穩。然而,不同麥汁樣品之間的形成速率和形成的自旋加合物水平存在差異。在氮氣氣氛下加熱麥汁樣品幾乎完全阻礙了自旋加合物的形成(數據未顯示)。這表明自旋加合物的形成與麥汁中的氧化反應密切相關。自旋加合物的形成預計是導致自由基形成的促氧化效應與淬滅自由基的抗氧化效應之間競爭的結果。因此,麥汁樣品的氧化穩定性通過自旋加合物形成的初始速率來量化,該速率是在強制老化期間自旋加合物濃度初始上升階段,在自旋加合物濃度開始趨于平穩之前確定的(圖3)。在抗氧化防御能力低(阻礙氧化過程)和/或促氧化成分水平高(有利于自由基形成)的麥汁樣品中,預計自由基形成的初始速率較高。無論哪種情況,與產生低自旋加合物形成速率的樣品相比,該麥汁的氧化穩定性預計會受損。
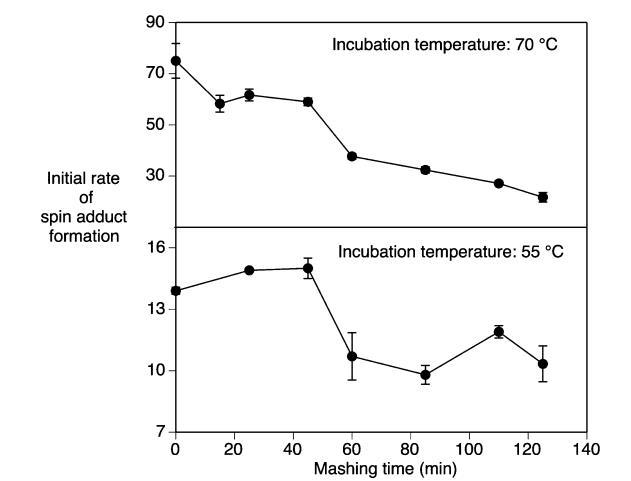
糖化過程中甜麥汁的氧化穩定性:在糖化程序的不同階段收集麥汁樣品,并通過自旋捕獲方法評估其氧化穩定性。通常,來自糖化初始低溫階段(投料)的麥汁樣品比后期高溫階段的樣品顯示出更高的自旋加合物形成速率(圖4)。當糖化溫度升高時,觀察到自旋加合物形成速率的明顯變化。這種變化也與收集的麥汁樣品中浸出物含量的變化相吻合(圖1)。因此,通過比較添加蔗糖增加溶解有機物含量后的麥汁樣品的自旋加合物形成速率,檢查了麥汁樣品中浸出物水平對自旋加合物形成速率的影響。當糖化25分鐘后收集的麥汁密度(8.4°Brix)通過添加蔗糖加倍(17.8°Brix)達到與糖化后期麥汁相當的浸出物含量時,自旋加合物的形成速率僅下降了24%。將麥汁密度增加到32°Brix并未導致自旋加合物形成速率的進一步降低(數據未顯示)。這表明蔗糖可能在一定程度上充當自由基清除劑。因此,與后期階段相比,糖化早期階段觀察到的自由基形成增加不能完全用°Brix的差異來解釋。另一方面,在糖化過程中溫度升高期間,醪液中發生了許多其他化學變化,例如淀粉的糊化和糖化、蛋白質的水解和變性、以及涉及脂質、蛋白質、多酚和碳水化合物的眾多氧化反應。
 相關新聞
相關新聞