熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
結果:
1.瘧原蟲感染增加鼠傷寒沙門氏菌的腸道定植
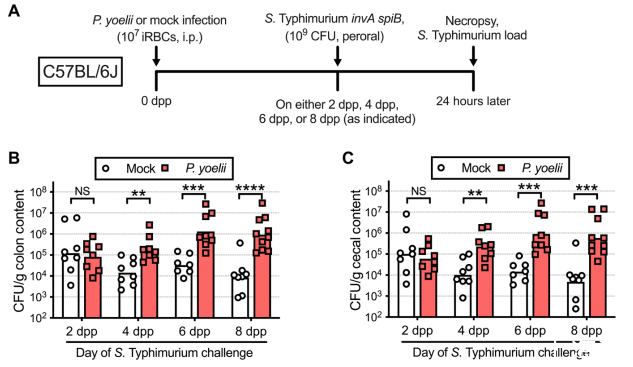
在實驗性瘧疾模型中,如約氏瘧原蟲(以下簡稱瘧原蟲),感染小鼠可改變腸道環境,降低對鼠傷寒沙門氏菌的定植抵抗力。然而,在感染后的較晚時間點,鼠傷寒沙門氏菌可以克服定植耐藥性,因為它的毒力因子,兩種III型分泌系統(T3SS-1和T3SS-2),引發腸道炎癥。為了從鼠傷寒沙門氏菌毒力因子對減弱定殖力的貢獻中分離出并發瘧疾的貢獻,在接種瘧原蟲后的不同時間點,小鼠組被感染野生型鼠傷寒沙門氏菌或缺乏T3SS-1(由于invA突變)和T3SS-2(由于SpiB突變)的invASpiB突變體(如圖1A所示)。當在瘧原蟲注射(DPP)后6天或更晚時,鼠傷寒沙門氏菌在感染瘧原蟲的小鼠的盲腸和結腸中定植的水平比對照小鼠高10到100倍(圖1B,1C,S1A)。這與鼠傷寒沙門氏菌的毒力無關,因為野生型和invA SpiB突變體都顯示出更強的定殖力(圖3)。6-dpp時間點與瘧原蟲在血液中擴展的高峰期相關(圖S2A)。此時,感染瘧原蟲的小鼠已持續出現嚴重貧血(圖S2B),體重大幅下降(圖S2C),而脾臟腫大在整個瘧原蟲感染過程中持續增加(圖S2D)。因此,6天后瘧原蟲接種被確定為最早的可靠時間點,以研究瘧疾相關定植抗性缺陷的根本原因,并被用作后續實驗的主要模型。
2.硝酸鹽和氧氣相關生長對促進鼠傷寒沙門氏菌定植的影響
由于瘧原蟲感染期間招募的巨噬細胞通過硝酸鹽呼吸作用促進共生腸桿菌的生長,而且先前的工作表明,瘧原蟲感染也會招募巨噬細胞到盲腸粘膜,因此我們假設,同時發生的瘧疾可能會增加管腔內硝酸鹽的供應量,從而促進傷寒桿菌的擴增。為了驗證這一觀點,我們用兩種菌株1:1的混合物感染小鼠,比較了鼠傷寒桿菌野生型與缺乏硝酸鹽還原酶活性的突變體(napA narG narZ cyxA突變體)的適應性。盡管共同感染組小鼠的腸道負擔總體上有所增加,但硝酸鹽呼吸的基因消減并沒有降低傷寒桿菌在瘧原蟲感染小鼠中的適應性(圖1D,E)。這一發現表明,在并發瘧疾期間,硝酸鹽的利用對于提高鼠傷寒桿菌的糞便恢復能力是不可或缺的。
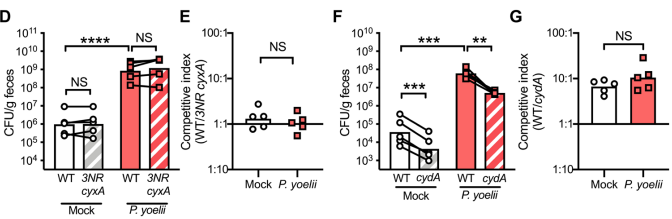
另外,有研究表明,炎癥也會通過增加氧氣的生物利用率而使傷寒桿菌受益。通過傷寒桿菌毒力相關的炎癥或服用抗生素來消耗梭狀芽孢桿菌,會導致微生物群中短鏈脂肪酸(SCFA)丁酸鹽的產生減少,而這種脂肪酸通常會促進負責維持管腔缺氧的結腸上皮細胞。丁酸鹽供應量的減少會使結腸細胞的初級新陳代謝從氧氣密集型的SCFA分解轉向氧氣密集型的SCFA分解,從而增加氧氣向結腸腔的擴散。這為沙門氏菌和大腸桿菌等使用細胞色素氧化酶的兼性厭氧菌的生長提供了額外的呼吸電子受體。我們之前的研究發現,瘧原蟲感染會影響微生物群,包括糞便中的梭狀芽孢桿菌相對減少,我們推測這可能是打開了結腸中的氧氣呼吸生態位,促進了沙門氏菌的生長。為了驗證這一觀點,我們比較了鼠傷寒沙門氏菌野生型與缺乏高親和力細胞色素bd氧化酶的突變體(cydA突變體)的適應性。然而,盡管cydA在受瘧原蟲感染的小鼠中提供了約10倍的體能優勢,但在未暴露于瘧原蟲的小鼠中也觀察到了類似的體能優勢(圖1F,G),這表明共同感染小鼠腸腔內氧的增加并沒有導致鼠傷寒桿菌水平的升高。總體而言,這些結果表明,增加對呼吸電子受體的可及性是不是瘧原蟲感染期間定植抗性缺陷的主要促成因素。
3.瘧原蟲感染不會迅速增加腸道內鼠傷寒沙門氏菌的復制
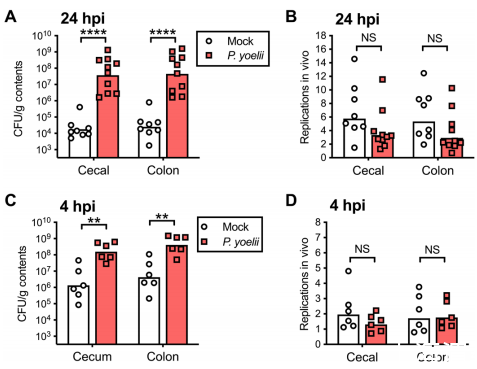
瘧原蟲沒有增強呼吸道生長缺陷,這讓我們產生了疑問:在共同感染的小鼠中,定植抗性的降低是否與鼠傷寒桿菌的快速生長有關?為了評估這個問題,我們給小鼠接種了攜帶乳糖抑制質粒pAM34的鼠傷寒桿菌,該質粒可用于短期評估細菌在低乳糖環境(如成年小鼠腸道)中的生長情況。挑戰24小時后,盡管共感染小鼠組的細菌定植量增加,但整個腸道的鼠傷寒沙門氏菌種群在瘧原蟲聯合感染和模型感染的小鼠中顯示出相同的復制率(圖2A,B)。耐人尋味的是,我們發現共感染小鼠在受到挑戰4小時后的傷寒桿菌定植率已經更高,這也與體內生長速度無關(圖2C,D)。鼠傷寒沙門氏菌感染量的這種快速差異并沒有伴隨著復制的增加,這表明細菌的快速生長并不是造成瘧原蟲感染小鼠定植增強的原因。
4.約氏瘧原蟲感染影響胃的抗菌防御
由于小鼠接種瘧原蟲后,傷寒桿菌載量的差異很快就出現了,因此我們推測,瘧原蟲感染可能會損害了固有的對細菌定植的“瓶頸”防御,這種防御在病原體攝入后期起作用。我們還觀察到,合并感染的小鼠在整個上消化道中往往表現出較高的鼠傷寒桿菌水平(圖S3A),看來合并感染的小鼠對鼠傷寒桿菌定植抵抗力的喪失可能發生在胃或小腸中。
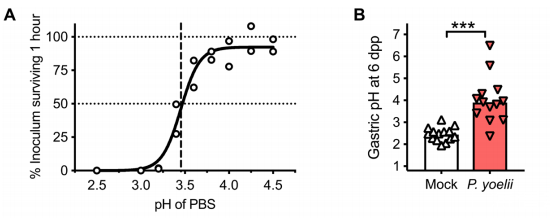
胃中的高酸性(pH值為1.5至3)環境是許多腸道病原體定植最嚴重的初始瓶頸之一。盡管鼠傷寒沙門氏菌在中性pH下生長旺盛,但在體外短期(60分鐘)暴露于低至pH4的酸性環境中也能存活(圖3A)。然而,接種的細菌在pH值為3.5或更低時迅速死亡,暴露于pH值為2.5或更低的培養基中的細菌無一存活(圖3A)。包括致病性和非致病性在內的許多腸桿菌都具有類似程度的酸敏感性(圖S4,A至E)。這一發現與之前的研究結果相吻合,表明傷寒桿菌和其他腸道病原體極易被胃中的酸性物質殺死。因此,胃酸維持不足可能導致攝入的鼠傷寒桿菌在腸道中存活率更高。
當使用pH感應微電極直接測量胃腔酸度時,與模擬感染小鼠(平均pH=2.46±0.32)相比,到6dpp時瘧原蟲感染與胃pH顯著升高(平均pH=4.02±1.07)相關(圖3B)。在感染瘧原蟲期間出現的低鹽血癥與定植抵抗力的喪失有關,因為在6dpp之前的小鼠中檢測不到低鹽血癥(圖S3B)。6dpp小鼠的胃普遍小于模擬感染對照組(圖S5A),部分原因可能是進食量減少(圖S5B),這與觀察到的寄生蟲感染期間體重下降模式一致(圖S2C)。由于進食可刺激胃酸分泌,我們預測觀察到的pH值差異是瘧疾期間進食量急劇減少的結果。禁食模擬感染小鼠一夜足以減輕胃重量(圖S5C),但與自由進食的喂養小鼠相比,禁食小鼠的胃pH值并沒有改變(圖S5D)。禁食也不能使禁食的模擬小鼠和感染了瘧原蟲的小鼠對接種的鼠傷寒桿菌的定植抗性恢復正常(圖S5E),這表明在瘧原蟲感染期間,胃酸度和對鼠傷寒桿菌定植的易感性的缺陷不僅僅是食物攝入量的急劇下降。
5.瘧疾引起的胃酸降低影響鼠傷寒沙門氏菌的定植
我們接下來想確定所觀察到的低鹽酸血癥是否真的是合并感染的傷寒桿菌存活率增加的原因。胃酸分泌通常是通過對胃頂細胞的刺激信號和抑制信號相結合來調節的,從而導致胃質子泵轉位到頂端膜并向胃腔主動分泌胃酸。最有效的分泌信號之一是組胺,它由胃腺中的腸石蠟樣細胞在局部釋放,與胃頂細胞的H2受體(H2R)結合。為了評估在感染瘧原蟲期間胃的高pH值是否是導致定植抵抗力缺陷的原因,在小鼠挑戰鼠傷寒沙門氏菌前1小時用特異性H2R激動劑二鹽酸地馬普利特刺激胃酸分泌。給予H2R激動劑可使感染瘧原蟲的動物的胃pH值迅速降至模擬感染水平(圖3C)。此外,在瘧原蟲感染的小鼠中,H2R刺激挽救了對鼠傷寒沙門氏菌的定植抗性(圖3D,E),而不影響寄生蟲感染,包括寄生蟲血癥(圖S6A)和貧血(圖S6B)。
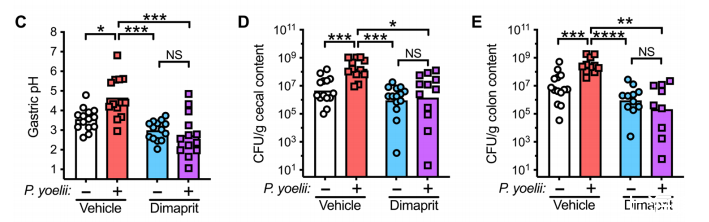
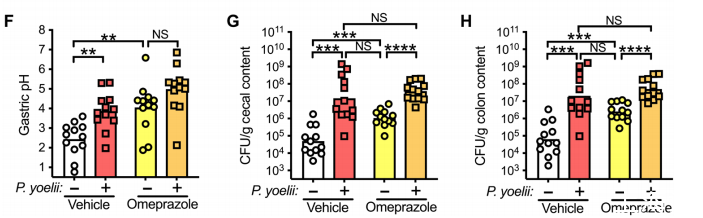
在補充實驗中,用質子泵抑制劑奧美拉唑治療小鼠,以阻止胃酸分泌到胃腔,然后再進行鼠傷寒桿菌挑戰。對照組小鼠接受奧美拉唑治療后,胃pH值(圖3F)和鼠傷寒桿菌定植(圖3G和H)相對于接受藥物治療的小鼠都有所上升,這與之前觀察到的結果相同。然而,與給予載體的瘧原蟲感染小鼠相比,給予奧美拉唑并不會進一步增加鼠傷寒桿菌的定植(圖3G,H),也不會影響寄生蟲感染的嚴重程度(圖S6,C和D)。這表明,僅感染瘧原蟲對胃pH值的影響就足以最大限度地幫助接種細菌更好地在胃環境中生存。總之,這些數據表明,感染瘧原蟲的小鼠胃酸減少是導致其對傷寒桿菌感染易感性增加的原因,因為寄生蟲相關的低鹽血癥是促進胃內接種細菌存活的必要條件,而胃酸減少反過來又會促進腸道定植。
 相關新聞
相關新聞