熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Efficient nitrous oxide production and metagenomics-based analysis of microbial communities in denitrifying systems acclimated with different electron acceptors
在適應不同電子受體的反硝化系統中,氧化亞氮的高效生產和基于宏基因組學的微生物群落分析
來源:International Biodeterioration & Biodegradation(2019年,第138卷)
論文總結
研究通過實驗和宏基因組分析,探究了不同電子受體(硝酸鹽 vs. 亞硝酸鹽)和自由亞硝酸(FNA)濃度對反硝化性能、氧化亞氮(N2O)生成及微生物群落的影響。以下是對論文的全面總結。
摘要概括
摘要指出,N2O是一種強效溫室氣體(溫室效應為CO2的265-298倍),但也可作為能源回收的潛在載體。研究比較了以硝酸鹽(SBR_A)和亞硝酸鹽(SBR_I)為電子受體的反硝化系統。在相同進水碳氮比(COD/N=4)下,SBR_A的硝酸鹽去除率為75.2%,而SBR_I的亞硝酸鹽去除率達99.8%。亞硝酸鹽為電子受體時,N2O轉化率最高達89.9%(SBR_A),歸因于電子競爭導致N2O還原酶(Nos)電子不足;FNA對Nos的抑制是N2O積累的主因,而非nos基因豐度。宏基因組分析顯示,SBR_A的優勢反硝化菌為Acidovorax(21.9%),SBR_I為Thauera(11.3%)。
研究目的
本研究旨在:
評估電子受體(NO3?-N vs. NO2?-N)和FNA濃度對反硝化效率及N2O生成的影響。
通過宏基因組學分析反硝化功能基因和微生物群落結構,揭示其與N2O積累的關聯。
為廢水處理中能源回收(以N2O形式)提供優化策略,最大化N2O產率。
研究思路
研究采用多方法結合的策略:
反應器設置與長期運行:兩個序批式反應器(SBR)分別以硝酸鹽(SBR_A)和亞硝酸鹽(SBR_I)為電子受體,在25°C下長期馴化(SRT=10天),監測出水氮濃度和污泥濃度(VSS)。
循環實驗與批次測試:進行典型SBR循環實驗,測量氮化物(NO3?-N、NO2?-N)、COD、溶解N2O動態;批次測試不同初始氮濃度(100、200、400 mg/L)下的反硝化速率和N2O生成。
FNA影響分析:通過公式計算FNA濃度(基于pH、溫度和NO2?-N濃度),評估其與N2O生成的關系。
微生物群落分析:利用16S rRNA測序和宏基因組學(Illumina平臺)分析功能基因(如nar、nir、nor、nos)豐度和微生物分類。
N2O測量技術:使用丹麥Unisense微電極(N2O-500-9707)在線監測溶解N2O,氣相N2O用氣相色譜(GC)分析。
測量數據及研究意義
以下列出關鍵測量數據、其來源(圖編號)及研究意義:
長期系統性能與循環實驗數據(來源:Fig. 1)
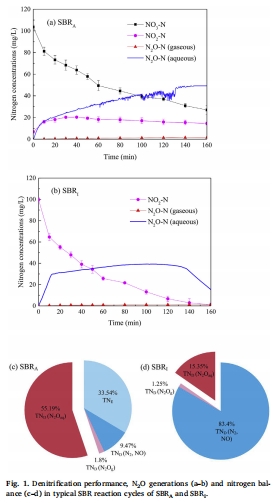
數據:SBR_A中,NO3?-N快速下降,NO2?-N和N2O積累初期達峰值(49.3 mg/L),N2O轉化率65.8%;SBR_I中,NO2?-N完全去除,N2O轉化率15.4%。電子消耗率顯示Nos競爭能力最弱。
研究意義:揭示反硝化動態中電子競爭機制:有機碳充足時,電子獨立供應各還原酶;碳限制時,Nos電子不足導致N2O積累。說明電子受體類型影響反硝化路徑效率。
電子受體對N2O生成的影響數據(來源:Fig. 2)
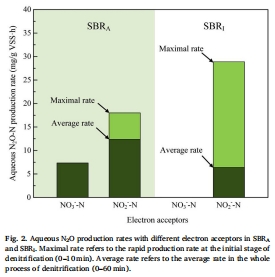
數據:亞硝酸鹽為電子受體時,SBR_A和SBR_I的初期N2O生成速率分別為18.0和28.9 mg N/g VSS·h,高于硝酸鹽系統(7.4和0.1 mg N/g VSS·h)。
研究意義:證實亞硝酸鹽直接作為電子受體會加劇Nir的電子需求,減少Nos可用電子,從而提升N2O產率。為優化電子受體選擇以最大化N2O回收提供依據。
FNA濃度對N2O生成的影響數據(來源:Fig. 3)
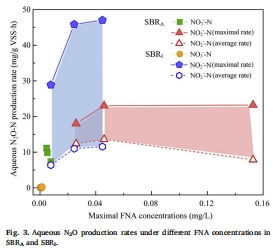
數據:FNA濃度范圍0.0002–0.1527 mg/L;亞硝酸鹽系統中,SBR_A的N2O轉化率最高達89.9%(FNA=0.0459 mg/L),而硝酸鹽系統轉化率低(<2.2%)。
研究意義:FNA通過抑制Nos活性(而非改變nos基因豐度)驅動N2O積累;高FNA環境(如亞硝酸鹽積累)可強化N2O生產,為工藝控制(如pH調節)提供理論支持。
反硝化基因豐度數據(來源:Fig. 4)
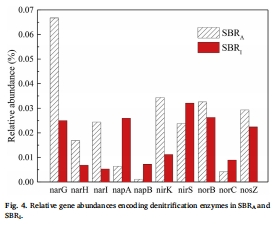
數據:SBR_A的nar基因豐度更高(占總基因0.1%),SBR_I的nir基因豐度相近;nosZ基因豐度類似(SBR_A:0.029%, SBR_I:0.022%),(nirK+nirS)/nosZ比值均≈1.9。
研究意義:基因豐度差異解釋馴化效應—SBR_A更適應硝酸鹽還原,但N2O積累主要受FNA調控而非基因數量,強調環境因子優于遺傳潛力在N2O生成中的作用。
微生物群落數據(來源:Fig. 5)
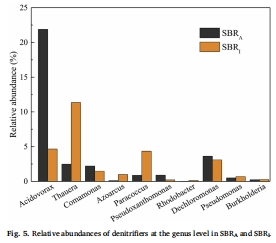
數據:SBR_A優勢菌為Acidovorax(21.9%),其攜帶大量nar基因(49.6%);SBR_I優勢菌為Thauera(11.3%),富含nosZ基因(35.7%)。
研究意義:電子受體長期馴化改變群落結構,Complete denitrifiers(如Thauera)在SBR_I中占優,但高FNA仍導致N2O積累,說明微生物功能受環境脅迫主導。
研究結論
本研究主要結論如下:
電子受體效應:亞硝酸鹽為電子受體時反硝化更完全(SBR_I去除率99.8%),但N2O產率更高(最高89.9%),因Nir競爭電子削弱Nos活性。
FNA核心作用:FNA濃度與N2O生成正相關,通過抑制Nos而非改變nos基因豐度驅動積累;FNA >0.0459 mg/L時抑制顯著。
微生物適應性:馴化導致群落分化—SBR_A以Acidovorax為主(適應硝酸鹽),SBR_I以Thauera為主(適應亞硝酸鹽),但功能基因表達受電子受體和FNA調控。
應用意義:通過控制電子受體(優先選亞硝酸鹽)和FNA濃度(如維持亞硝酸鹽積累),可優化廢水處理工藝以實現高效N2O能源回收。
丹麥Unisense電極測量數據的詳細解讀
在本研究中,丹麥Unisense微電極系統(型號N2O-500-9707)用于在線監測溶解N2O濃度,其研究意義體現在以下方面:
高精度實時監測:Unisense電極提供nM級分辨率,直接測量液相N2O,避免頂空采樣誤差,實現秒級動態追蹤。例如,在批次測試(Fig. 2和Fig. 3)中,電極實時捕獲N2O生成曲線:初期快速上升(0–10分鐘)反映電子競爭激烈期,后期平臺或下降反映底物消耗與Nos活性恢復。這種時間分辨率揭示了反硝化過程的非線性動力學,這是傳統離線GC無法實現的。
量化N2O生成速率:電極數據用于計算最大和平均N2O生成速率(如Fig. 2中SBR_I初期速率28.9 mg N/g VSS·h),直接關聯電子受體類型。速率差異證實亞硝酸鹽系統更易積累N2O,因Nir直接競爭電子,而硝酸鹽系統需先還原為亞硝酸鹽,緩沖了電子需求。
驗證FNA抑制機制:通過同步測量pH、NO2?-N和N2O(Fig. 3),電極數據揭示FNA濃度與N2O積累的劑量效應:FNA >0.02 mg/L時,N2O生成率陡升,直觀證明FNA對Nos的可逆抑制(如結合Cu活性位點)。電極的連續監測避免了采樣間隔導致的信號丟失,確證FNA是N2O積累的關鍵驅動因子。
支持代謝路徑分析:電極數據顯示,亞硝酸鹽系統中N2O積累初期高但后期下降(如SBR_I中N2O從峰值下降),反映底物耗盡后Nos活性恢復;而硝酸鹽系統N2O持續累積,表明電子分配路徑差異。這些數據與宏基因組結果互補,說明盡管nos基因存在,環境脅迫(如FNA)更能調控實際排放。
技術優勢與生態意義:Unisense電極的微尺度測量(直接液相檢測)減少人為干擾,適用于復雜廢水基質;其應用使N2O生成量化更準確,為工藝優化(如通過實時調控FNA)提供可靠工具,助力廢水處理廠從“減排”轉向“能源回收”。
總之,丹麥Unisense電極數據是本研究的實驗基石,通過提供實時、高精度的N2O動力學數據,它直接驗證了電子競爭和FNA抑制機制,突出了亞硝酸鹽作為電子受體在N2O能源化中的潛力,并為理解微生物代謝響應提供了關鍵時間維度證據。