熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Functional analysis of active amino acid residues of the mercaptosuccinate dioxygenase of Variovorax paradoxus B4
七葉樹巰基琥珀酸二加氧酶活性氨基酸殘基的功能分析
來源:Enzyme and Microbial Technology(2019年,第120卷)
論文總結
研究通過定點誘變和生化分析,探究了Variovorax paradoxus B4中巰基琥珀酸雙加氧酶(Msdo)活性位點關鍵氨基酸殘基的功能作用。以下是對論文的詳細總結。
摘要概括
摘要指出,巰基琥珀酸(MS)是一種廣泛應用于量子點穩定、化妝品等領域的有機硫化合物,其細菌代謝途徑中的關鍵酶——巰基琥珀酸雙加氧酶(Msdo)于2014年被鑒定為一種新型細菌硫醇雙加氧酶。Msdo屬于cupin超家族,是一種非血紅素單核鐵蛋白,催化MS轉化為琥珀酸和亞硫酸鹽。為深入解析其酶活性相關的潛在重要氨基酸殘基,研究通過定點誘變生成并分析了七個酶變體。結果表明,三個保守組氨酸殘基(H93、H95、H163)的突變導致酶完全失活,證實它們對鐵輔因子協調或底物定位至關重要;C100S突變也導致失活,表明該半胱氨酸對蛋白穩定性或活性重要;Q64A突變增加了Km值(0.29 mM vs 野生型0.06 mM),但不顯著影響比活性;R66A突變僅顯示極低活性;Y165F突變對酶活性影響較小(比活性10.22 μmol min?1 mg?1,Km 0.06 mM)。研究揭示了Msdo活性位點的關鍵殘基及其功能差異。
研究目的
本研究旨在解決以下核心問題:
鑒定Msdo酶中對其催化活性至關重要的氨基酸殘基,特別是參與鐵輔因子協調、底物定位和結構穩定的殘基。
通過比較突變體與野生型酶的動力學參數(如Km、Vmax),評估這些殘基的功能重要性。
揭示Msdo與真核半胱氨酸雙加氧酶(Cdo)在活性位點結構上的異同,深化對硫醇雙加氧酶家族進化關系的理解。
研究思路
研究采用多步驟實驗策略:
定點誘變:基于序列比對和結構預測,選擇7個潛在重要殘基(Q64、R66、H93、H95、C100、H163、Y165),通過PCR介導的定點誘變生成變體(如H93L、Q64A等)。
蛋白表達與純化:變體在E. coli BL21(DE3)中表達,通過鎳柱親和色譜純化,SDS-PAGE驗證純度。
酶活性定性篩選:使用Ellman試劑(DTNB)檢測游離巰基消耗,初步評估變體活性。
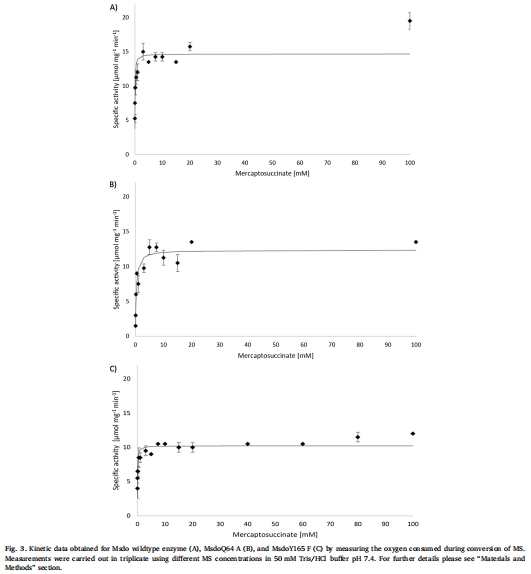
定量動力學分析:使用氧電極(Rank Brothers Dual Digital Model 20)實時測量氧消耗,計算Km、Vmax和kcat值(Fig. 3)。
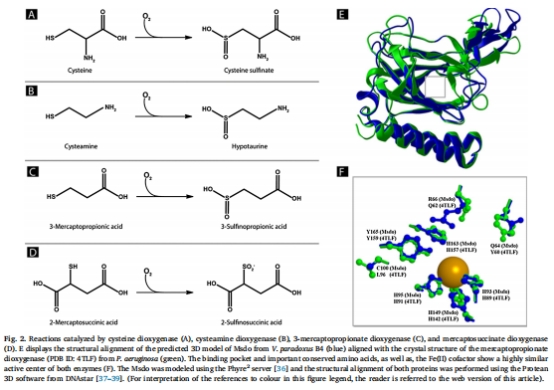
結構比對與建模:通過Phyre2服務器預測Msdo三維結構,并與已知結構(如Pseudomonas aeruginosa Mdo)比對(Fig. 2)。
數據整合:比較變體與野生型的動力學參數,結合序列保守性,推斷殘基功能。
測量數據及其研究意義
以下列出關鍵測量數據、其來源(圖或表編號)及研究意義:
酶活性篩選數據(來源:方法部分,Ellman試劑測定)
數據:變體H93L、H95L、H163L和C100S在定性測定中完全無活性;R66A活性極低;Q64A和Y165F保留活性。
研究意義:初步確認H93、H95、H163和C100為酶活性必需殘基,為后續定量分析提供基礎。
動力學參數數據(來源:Fig. 3 和 Table 2)
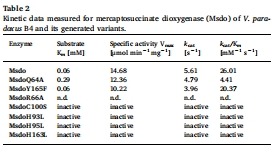
數據:野生型Msdo的Km為0.06 mM,Vmax為14.68 μmol min?1 mg?1,kcat為5.61 s?1;Q64A變體Km升高至0.29 mM,Vmax為12.36 μmol min?1 mg?1;Y165F變體Km與野生型相同(0.06 mM),Vmax為10.22 μmol min?1 mg?1;R66A變體因活性過低未獲動力學數據。
研究意義:Km變化表明Q64可能參與底物結合(親和力降低);Y165F的輕微活性下降提示該殘基非催化必需;數據支持Msdo可能屬于"Arg型"Cdo同源物(因R66關鍵而Q64非必需)。
結構比對數據(來源:Fig. 1 和 Fig. 2)

數據:多序列比對顯示H93、H95、H163嚴格保守,形成鐵協調3-His面部三聯體;真核Cdo中氫鍵網絡殘基(如R60、Y157)在Msdo中對應為R66、Y165。
研究意義:揭示Msdo與真核Cdo的活性位點保守性,但Y165非關鍵表明細菌酶可能缺乏真核中Cys-Tyr交聯,突出了進化差異。
研究結論
本研究得出以下核心結論:
關鍵殘基的必需性:H93、H95(鐵協調)、H163(底物定位)和C100(結構穩定)的突變導致酶完全失活,證實它們對Msdo活性不可或缺。
底物結合與催化分工:R66可能參與底物定位氫鍵網絡(突變后活性驟降),而Q64影響底物親和力但不破壞催化活性;Y165可被替代(苯丙氨酸突變影響小),表明其在Msdo中非催化三聯體組成部分。
進化啟示:Msdo活性位點與真核Cdo高度相似但功能有異,如Y165的作用較弱,提示細菌硫醇雙加氧酶可能通過殘基冗余適應不同底物特異性。
應用前景:闡明Msdo關鍵殘基有助于設計高效酶變體,用于巰基琥珀酸降解或聚硫酯生物合成。
丹麥Unisense電極測量數據的詳細解讀
在本研究中,氧電極系統(包括Rank Brothers Dual Digital Model 20電極和PicoLog數據記錄儀)用于定量測量酶促反應中的氧消耗,其研究意義主要體現在:
高精度動力學參數獲取:電極實時監測氧濃度變化(校準至25℃下溶解氧最大值0.2409 μmol/mL),通過非線性回歸計算Km、Vmax和kcat(如Fig. 3所示)。這些數據提供了酶催化效率的定量基準,使變體間比較成為可能(如Q64A的Km升高直接反映底物親和力下降)。
技術優勢驗證假設:電極的靈敏度和實時性(方法部分描述溫度控制至25±0.1℃)確保了動力學測量的準確性。例如,野生型Msdo的Km(0.06 mM)與本團隊前期研究(0.4 mM)的差異歸因于電極系統的改進(無需移除電極添加酶),突出了該技術對減少實驗誤差的價值。
支持活性位點功能推斷:通過對比變體與野生型的氧消耗曲線,電極數據直接揭示了殘基功能——如R66A需高酶量(38 μg/mL)才檢測到活性,表明其可能參與關鍵氫鍵網絡;而Y165F的氧消耗曲線與野生型相似,支持其非必需角色。
生理相關性:氧電極模擬了生理好氧條件(酶依賴O?催化),測量數據反映了Msdo在細菌代謝中的真實效率,為理解V. paradoxus B4的MS降解途徑提供了生化基礎。
方法論意義:本研究展示了氧電極在酶動力學研究中的可靠性,為其他硫醇雙加氧酶的功能分析提供了技術范本。
總之,氧電極測量數據是本研究的核心,通過提供精確的動力學參數,它直接驗證了關鍵氨基酸殘基在Msdo催化中的作用,揭示了酶活性位點的功能分工。這項技術強調了實時氧監測在酶學機制研究中的不可替代性,為優化工業生物催化劑提供了關鍵見解。