熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Two uptake hydrogenases differentially interact with the aerobic respiratory chain during mycobacterial growth and persistence
分枝桿菌生長和持續過程中,兩種攝取氫化酶與有氧呼吸鏈的相互作用不同
來源:Journal of Biological Chemistry(2019年,第294卷,第50期)
論文總結
研究通過綜合運用遺傳學、生物化學和生理學方法,探究了恥垢分枝桿菌(Mycobacterium smegmatis)中兩種高親和力[NiFe]氫酶(Huc和Hhy)在生長和持久期的差異表達、定位及與好氧呼吸鏈的整合機制。以下是對論文的詳細總結。
摘要概括
摘要指出,好氧土壤細菌通過氧化大氣氫氣(H?)支持其在營養限制環境中的生存,這是全球H?循環的主要匯。M. smegmatis 編碼兩種[NiFe]氫酶(Huc和Hhy),它們均能氧化H?至亞大氣濃度,并增強細菌在缺氧和碳限制下的生存能力。但為何需要兩種功能相似的氫酶?本研究證實,Huc和Hhy差異表達、定位和整合到呼吸鏈中:Huc在指數后期和靜止早期活躍,支持混合營養生長和向休眠過渡的能量守恒;Hhy在長期持久期活躍,提供碳耗盡后的維持能量。兩者通過menaquinone池與好氧呼吸鏈 obligately 連接,但差異受呼吸解偶聯劑影響。Huc專門捐贈電子給質子泵 cytochrome bcc-aa? 超復合物,而Hhy也提供給 cytochrome bd 氧化酶復合物。結果表明,盡管相似,Huc和Hhy在分枝桿菌生長和生存中執行 distinct 功能。
研究目的
本研究旨在解決以下核心問題:
探究Huc和Hhy在M. smegmatis生長和持久期的差異表達模式及活性動態。
確定這兩種氫酶如何整合到好氧呼吸鏈中,包括與終端氧化酶的特異性耦合。
理解它們與呼吸鏈組件(如menaquinone池)的相互作用及對質子動勢(PMF)的依賴。
闡明大氣H?氧化作為能源在細菌生存中的生理作用,為微生物能量代謝提供新見解。
研究思路
研究采用多層次實驗策略:
遺傳學方法:構建突變體 strains(Huc-only、Hhy-only、雙突變等),通過等位基因交換和StreplI標簽插入,驗證氫酶功能。
基因表達分析:使用qRT-PCR定量hucL和hhyL轉錄本在不同生長階段(指數期、靜止期、持久期)的表達水平。
酶活性測量:通過活性染色(zymography)和藍 native PAGE 檢測氫酶活性及分子質量;使用丹麥Unisense H?和O?微電極實時測量整體細胞H?氧化和O?消耗速率。
細胞分餾與定位:Western blotting 分析氫酶在細胞質和膜組分的分布,評估膜關聯強度。
呼吸鏈耦合實驗:應用呼吸抑制劑(如HQNO、鋅疊氮)和解偶聯劑(如valinomycin、nigericin),研究電子傳遞路徑和PMF依賴。
質譜分析:鑒定活性染色條帶中的蛋白質組分,揭示氫酶與呼吸鏈復合物的潛在相互作用。
數據整合:結合動力學測量和抑制劑響應,構建氫酶整合模型。
測量數據及其研究意義
以下列出關鍵測量數據、其來源(圖編號)及研究意義:
基因表達與活性動態數據(來源:Figure 1)
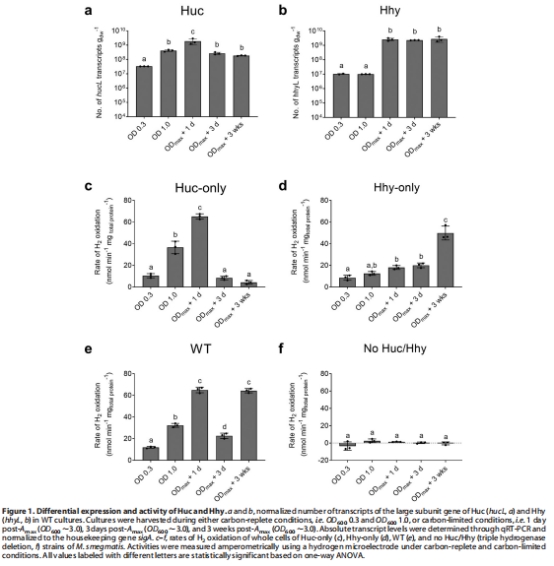
數據:qRT-PCR顯示hucL在碳限制過渡期(1天 post-Amax)表達峰值(54倍誘導),隨后下降;hhyL在持久期(3周 post-Amax)高表達。H2氧化速率測量表明Huc活性在過渡期最高,Hhy活性在持久期顯著增強。
研究意義:證實Huc和Hhy的時序差異調節——Huc用于生長-休眠過渡的混合營養能量供應,Hhy用于長期持久維持,支持 survival 策略的分化。
酶活性與定位數據(來源:Figure 2)
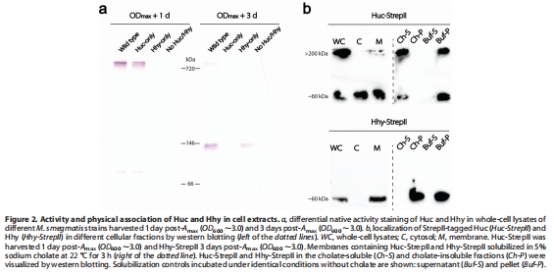
數據:活性染色顯示Huc形成高分子質量復合物(>700 kDa),Hhy為中分子質量(~66 kDa);Western blotting 顯示Huc部分膜關聯(膽酸鈉可溶),Hhy強膜關聯(膽酸鈉不溶)。
研究意義:表明Huc可能通過蛋白質相互作用與膜結合(如與cytochrome bcc-aa?超復合物),而Hhy直接嵌入膜;這解釋了功能差異的結構基礎。
呼吸耦合數據(來源:Figure 3)
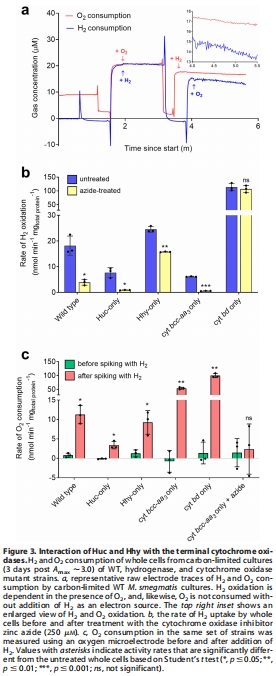
數據:微電極測量顯示H2氧化依賴O2, stoichiometry 約2:1(H2:O2);抑制劑實驗表明鋅疊氮(cytochrome bcc-aa?抑制劑)強烈抑制Huc活性(8.4倍降低),對Hhy影響小(1.5倍降低)。
研究意義:直接證明H2氧化耦合到呼吸鏈O2還原;Huc obligately 耦合 cytochrome bcc-aa?,Hhy promiscuously 耦合 cytochrome bd 和 bcc-aa?,顯示電子傳遞路徑的差異。
抑制劑響應數據(來源:Figure 4)
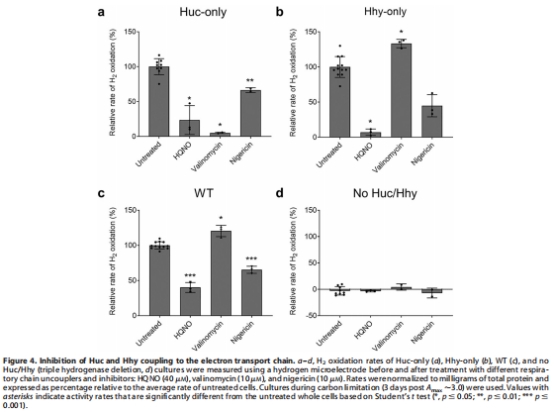
數據:HQNO(menaquinone抑制劑)抑制Huc和Hhy活性(8.6-10.4倍降低),證實電子傳遞通過menaquinone池;valinomycin(PMF解偶聯劑)強烈抑制Huc(20倍降低)但增強Hhy(1.3倍增加)。
研究意義:表明Huc依賴PMF(可能因耦合質子泵氧化酶),Hhy不依賴且更靈活;突出能量代謝策略差異——Huc用于高效能量守恒,Hhy用于低維持成本。
整合模型(來源:Figure 5)
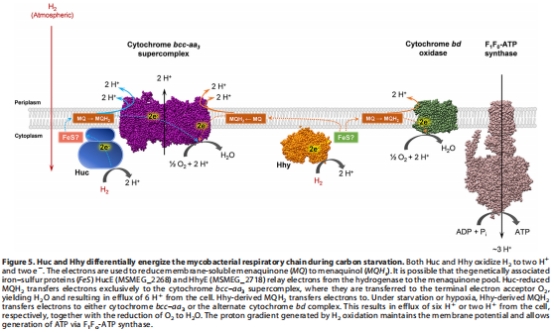
數據:示意圖總結Huc和Hhy電子傳遞路徑:Huc專一捐贈電子給cytochrome bcc-aa?(泵6H?),Hhy捐贈給cytochrome bd(泵2H?)或bcc-aa?。
研究意義:提供整體框架,解釋氫酶如何支持不同生理狀態;大氣H?作為關鍵能源,增強細菌在 oligotrophic 環境中的適應性。
研究結論
本研究得出以下核心結論:
功能分化:Huc和Hhy雖均氧化大氣H?,但時序和功能差異——Huc支持生長-休眠過渡的混合營養,耦合高效質子泵氧化酶;Hhy支持長期持久,耦合低效氧化酶,提供維持能量。
呼吸鏈整合:兩者均通過menaquinone池傳遞電子,但耦合不同終端氧化酶;Huc依賴PMF,Hhy更靈活,適應多變環境。
生理意義:大氣H?氧化是M. smegmatis的核心生存策略,氫酶分化優化了能量利用,解釋了其在土壤中的持久性。
廣泛適用性:類似機制可能存在于其他好氧細菌,強調痕量氣體代謝在微生物生態中的重要性。
丹麥Unisense電極測量數據的詳細解讀
在本研究中,丹麥Unisense微電極系統(H?和O?微電極)用于實時測量整體細胞的H?氧化和O?消耗速率,其研究意義主要體現在:
高分辨率實時監測:Unisense電極提供μM級檢測限,允許在生理條件下(如PBS緩沖液,pH 7.4)實時追蹤H?和O?動力學(Figure 3a)。例如,直接顯示H?氧化速率隨O?添加而增加,證實呼吸耦合,且 stoichiometry 約2:1(H?:O?),符合 aerobic respiration 理論。
定量動力學參數:電極數據用于計算表觀速率(如Vmax和Km),并評估抑制劑效應(Figure 3b-c, 4)。例如,鋅疊氮處理導致Huc活性大幅降低,直接證明其與cytochrome bcc-aa?的特異性耦合。
原位與無擾動測量:電極直接在整體細胞懸浮液中測量,避免提取或純化帶來的擾動,確保數據生理相關性。這尤其重要 for 驗證氫酶在原生環境中的功能。
支持關鍵假設:數據證實H?氧化依賴O?,且電子傳遞通過呼吸鏈;抑制劑響應差異(如valinomycin對Huc和Hhy的相反效應)為PMF依賴提供直接證據,支撐功能分化模型。
技術優勢:Unisense系統的靈敏度和實時性使其成為研究氣體代謝酶的理想工具,本研究通過結合遺傳和生化數據,強化了大氣H?作為能源的結論。
總之,丹麥Unisense電極數據是本研究的基石,通過提供精確的呼吸速率測量,它直接驗證了氫酶與呼吸鏈的耦合機制,揭示了Huc和Hhy的功能差異。這項技術突出了原位呼吸測量在微生物生理學研究中的價值,為理解細菌能量代謝提供了關鍵實證。