熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Heterogeneity in respiratory electron transfer and adaptive iron utilization in a bacterial biofilm
細菌生物膜中呼吸電子轉移的異質性和鐵的適應性利用
來源:Nature Communications 2019年,第10卷,文章編號3702
論文總結
研究通過多學科方法探究了枯草芽孢桿菌(Bacillus subtilis)生物膜形成過程中鐵離子的獨特利用策略,揭示了細胞內外電子傳遞的異質性及其對生物膜發育的關鍵作用。以下是對論文的詳細總結。
摘要概括
摘要指出,枯草芽孢桿菌的 robust 生物膜形成需要大量鐵離子(Fe3?)。研究發現,這一過程依賴于優先產生鐵載體前體2,3-二羥基苯甲酸(DHB),而非完整鐵載體 bacillibactin。大部分鐵與生物膜基質 extracellularly 結合,生物膜表現出導電性,細胞外鐵可能作為電子受體。較少比例的Fe3?被內化,用于增強含鐵酶(如呼吸鏈酶)的生產,從而建立強膜電位,促進生物膜基質合成。研究強調了枯草芽孢桿菌生物膜內的代謝多樣性和適應性能量生成策略。
研究目的
本研究旨在解決以下核心問題:
探究為什么枯草芽孢桿菌生物膜形成需要異常高量的鐵(數百倍于生長需求)。
揭示鐵在生物膜中的具體作用機制,包括吸收、利用和其在電子傳遞中的角色。
闡明生物膜內細胞間代謝異質性,特別是氧限制區域細胞的能量代謝策略。
研究思路
研究采用多層次實驗設計:
遺傳學方法:構建枯草芽孢桿菌突變體(如dhbA-F操作子突變體),評估生物膜表型,并通過化學補充(如DHB)驗證關鍵分子作用。
分子生物學技術:使用實時定量PCR(RT-qPCR)分析基因表達;β-半乳糖苷酶報告系統檢測啟動子活性。
生化分析:采用電感耦合等離子體質譜(ICP-MS)測量細胞內和細胞外鐵濃度;循環伏安法(CV)評估生物膜導電性和電子傳遞能力。
微生物學技術:使用熒光染料(如硫黃素T, ThT)測量膜電位;丹麥Unisense微電極系統測量氧濃度和氧化還原電位剖面。
數據整合:結合遺傳、生化和電化學數據,構建模型解釋鐵在生物膜中的雙重角色。
測量數據及其研究意義
以下列出關鍵測量數據、其來源(圖或表編號)及研究意義:
生物膜表型數據(來源:Fig. 1)
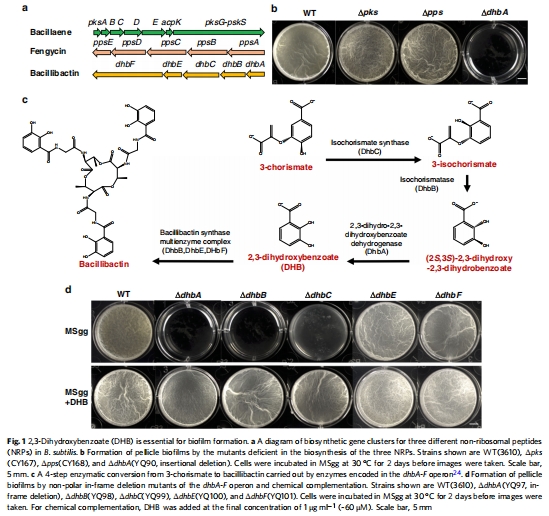
數據:dhbA、dhbB、dhbC突變體顯示嚴重生物膜缺陷,而dhbE和dhbF突變體表型正常;補充DHB(1 μg/mL)能挽救突變體表型。
研究意義:表明DHB(而非bacillibactin)是生物膜形成的關鍵,揭示了鐵載體前體的適應性優勢。
基因表達數據(來源:Fig. 2)
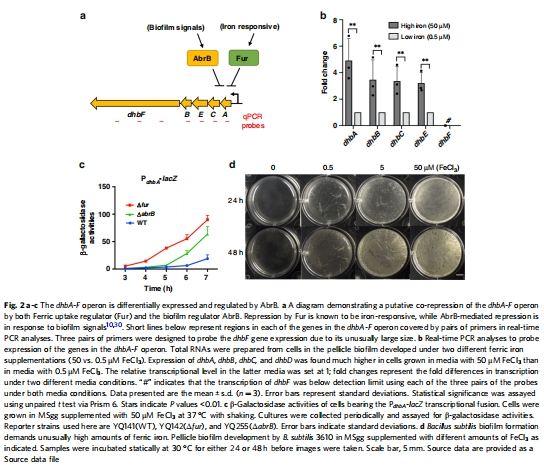
數據:RT-qPCR顯示dhbA、dhbB、dhbC、dhbE在生物膜中高表達,但dhbF表達低于檢測限;β-半乳糖苷酶活性證實AbrB和Fur共同調控dhb操作子。
研究意義:揭示了dhb操作子的差異表達,支持DHB優先生產的調控機制,適應高鐵環境。
代謝酶突變體數據(來源:Fig. 3)
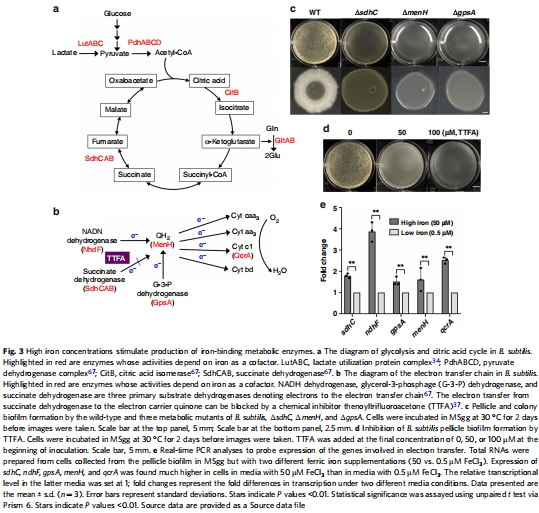
數據:ΔsdhC、ΔmenH、ΔgpsA突變體生物膜缺陷;RT-qPCR顯示高鐵條件(50 μM FeCl?)下電子傳遞鏈基因(sdhC、ndhF、gpsA等)表達上調;抑制劑TTFA(50-100 μM)抑制生物膜形成。
研究意義:表明含鐵呼吸酶對生物膜至關重要,鐵通過增強電子傳遞鏈功能促進膜電位建立。
膜電位數據(來源:Fig. 4)
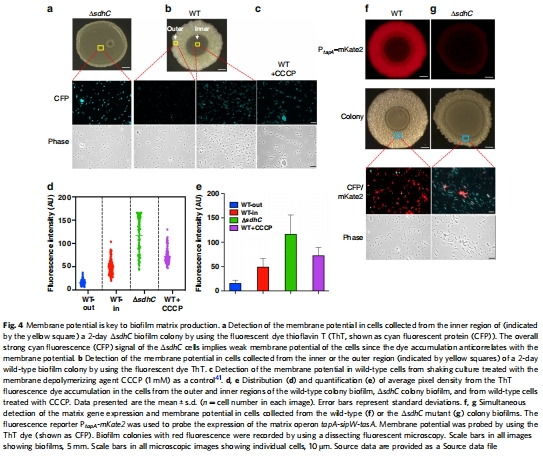
數據:ThT熒光顯示ΔsdhC突變體膜電位低;野生型生物膜外圍細胞膜電位高,與基質基因表達正相關。
研究意義:直接 linking 膜電位與基質生產,呼吸電子傳遞是膜電位建立的關鍵。
鐵分布數據(來源:Fig. 5)
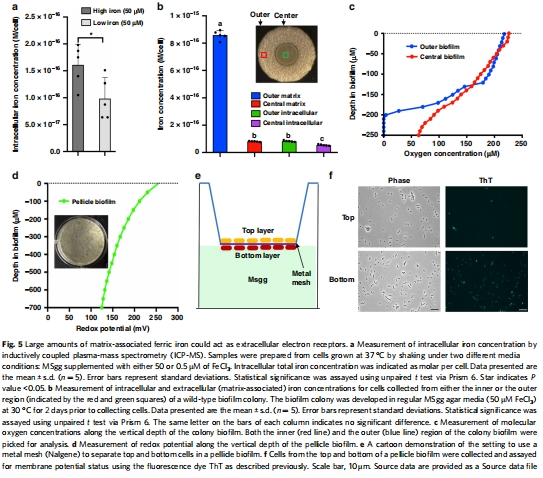
數據:ICP-MS顯示細胞內鐵濃度變化小(<1倍),但細胞外基質相關鐵濃度高(10倍于細胞內);氧微電極顯示生物膜深度增加氧濃度降低;氧化還原微電極顯示底部還原性增強。
研究意義:揭示鐵主要存在于細胞外基質中,可能作為電子受體;生物膜內氧梯度導致代謝異質性。
電化學數據(來源:Fig. 6)
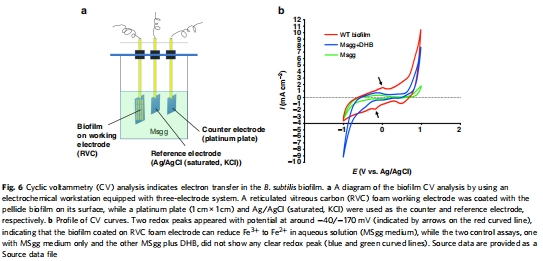
數據:循環伏安法顯示生物膜涂層電極能還原Fe3?( redox peaks at -40/-170 mV),而對照無此現象。
研究意義:證明生物膜具有細胞外電子傳遞(EET)能力,鐵作為電子受體。
補充數據(來源:Supplementary Figures)
數據:生長曲線顯示鐵濃度對生長影響小;酶活性數據等。
研究意義:支持主要結論,排除生長抑制作為生物膜缺陷的原因。
研究結論
本研究得出以下核心結論:
DHB的適應性優勢:枯草芽孢桿菌在生物膜條件下優先生產DHB而非bacillibactin,以更高效地 solubilize 和利用鐵。
鐵的雙重角色:內化鐵增強呼吸酶活性和膜電位,促進基質生產;細胞外鐵作為電子受體支持EET,尤其在氧限制區域。
代謝異質性:生物膜頂部細胞依賴氧進行細胞內電子傳遞(IET),底部細胞利用EET維持能量代謝,體現了呼吸策略的多樣性。
調控機制:AbrB和Fur共同調控dhb操作子,響應生物膜信號和鐵可用性。
丹麥Unisense電極測量數據的詳細解讀
在本研究中,丹麥Unisense微電極系統用于原位測量生物膜內的氧濃度和氧化還原電位剖面,其研究意義主要體現在:
高分辨率原位測量:Unisense氧微電極(型號OX-50,尖端直徑50 μm)和氧化還原微電極(型號RD-500)提供微米級空間分辨率(步長10-50 μm),能夠實時、無擾動地測量生物膜微環境中的氧動力學和氧化還原狀態(Fig. 5c, d)。這避免了傳統取樣方法可能引入的擾動,確保了數據的準確性和可靠性。
揭示生物膜異質性:氧剖面數據(Fig. 5c)顯示,從生物膜頂部到底部,氧濃度逐漸降低(在 outer region 從~200 μM降至接近0),表明生物膜內部存在顯著氧梯度。這直接證明了頂部細胞好氧、底部細胞缺氧的微環境差異,為代謝異質性提供了直接證據。氧化還原剖面數據(Fig. 5d)顯示,pellicle biofilm 底部氧化還原電位降低(還原性增強),表明缺氧區域可能發生還原反應,如Fe3?還原。
支持EET機制:氧化還原數據與電化學數據(Fig. 6)結合,表明底部細胞可能利用細胞外鐵作為電子受體進行厭氧呼吸(EET),從而維持膜電位和能量生產。這解釋了為什么生物膜底部細胞在缺氧條件下仍能保持活力(如 live/dead 染色所示)。
技術優勢與貢獻:Unisense系統的實時和高精度測量能力,使其成為研究生物膜微環境的黃金標準。這些數據直接支撐了研究的核心模型——生物膜內IET和EET的共存,強調了鐵在跨尺度電子傳遞中的關鍵作用。沒有這些原位測量,生物膜異質性和EET假設將缺乏實證基礎。
總之,丹麥Unisense電極數據是本研究的基石,通過提供精確的微環境剖面,它直接揭示了生物膜內的氧和氧化還原梯度,為理解鐵適應性利用和電子傳遞異質性提供了關鍵證據。這項技術突出了原位測量在微生物生態研究中的不可替代價值。