熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Immobilization of functional nano-objects in living engineered bacterial biofilms for catalytic applications
在生物工程細菌生物膜中固定化功能性納米物體的催化應用
來源:National Science Review(2019年)
論文總結
研究通過基因工程改造大腸桿菌生物膜,將功能性納米物體(如金納米顆粒、量子點)固定在胞外基質中,構建了高效、可重復使用的催化系統。以下是對論文的詳細總結。
摘要概括
摘要指出,納米物體因其高比表面積在催化中具有獨特優勢,但存在毒性、回收難和二次污染等問題。固定化是解決這些限制的有效策略。本研究作為概念驗證,利用工程化大腸桿菌生物膜的淀粉樣纖維(如CsgA蛋白)分泌和自組裝能力,通過His標簽和配位化學(如NTA-Metal-His)在空間精確錨定納米物體。研究展示了三個可擴展、可調諧和可重復使用的催化系統:生物膜錨定金納米顆粒(Au NPs)還原污染物對硝基苯酚(PNP)、生物膜錨定混合Cd?.?Zn?.?S量子點(QDs)和金納米顆粒降解有機染料(如剛果紅CR)、以及生物膜錨定CdSeS@ZnS量子點的半人工光合作用系統產氫。工作證明了生物膜在復雜空間排列中生長的能力可用于催化應用,并闡明了通過工程化胞外基質錨定點將高能納米物體與易損傷細胞組件分離的設計效用。
研究目的
本研究旨在解決以下核心問題:
開發一種活體生物膜固定化納米催化劑的方法,避免納米材料的毒性釋放和環境污染。
利用生物膜的自再生、可擴展性(通過細胞生長)和遺傳可調性,實現催化系統的可持續操作。
構建多功能催化平臺,應用于環境修復(如污染物降解)和能源生產(如產氫)。
探究納米物體與生物膜界面的相互作用機制,如電荷分離和空間富集效應。
研究思路
研究采用“基因工程-納米固定化-催化驗證”的多層次策略:
生物膜工程:改造大腸桿菌菌株(如TcReceiver/CsgAHis),表達含His標簽的淀粉樣單體(CsgAHis),使其分泌并自組裝成纖維,形成生物膜基質。
納米物體固定化:通過一鍋法(原位培養)或后修飾法,利用His標簽與NTA-金屬配位或靜電相互作用,將納米物體(如Au NPs、CdZnS QDs)錨定在生物膜纖維上。
催化系統設計:
PNP還原系統:生物膜錨定Au NPs,在NaBH?存在下催化PNP還原為對氨基苯酚(PAP)。
有機染料降解系統:生物膜共錨定Cd?.?Zn?.?S QDs和Au NPs,利用光誘導電荷分離降解CR等染料。
產氫系統:生物膜錨定CdSeS@ZnS QDs作為光敏劑,與工程化菌株(表達[FeFe]氫酶)耦合,在光驅動下產氫。
表征與評估:使用TEM、EDS、UV-Vis光譜、熒光光譜等技術分析納米物體錨定效果和催化性能;通過循環實驗評估可重復使用性;利用丹麥Unisense微傳感器實時監測氫生產。
測量數據及其研究意義
以下列出關鍵測量數據、其來源(圖編號)及研究意義:
納米物體錨定形態數據(來源:Figure 2a, 3b, 3e, 4b)
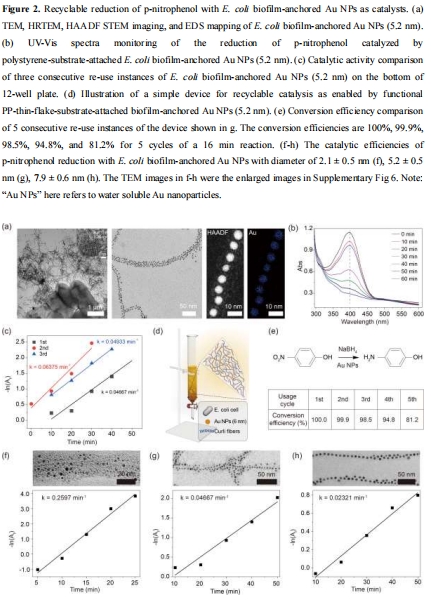
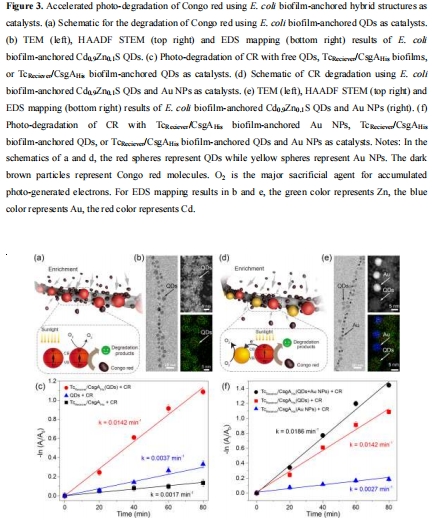
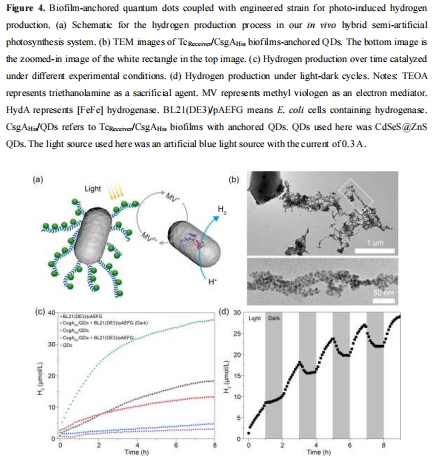
數據:TEM和EDS映射顯示納米物體(如Au NPs、QDs)均勻錨定在生物膜纖維上,尺寸與原始合成物一致(如Au NPs直徑2.1-7.9 nm)。
研究意義:證實His標簽介導的固定化有效性,納米物體在生物膜中空間有序分布,為催化提供高表面積界面。
PNP還原動力學數據(來源:Figure 2b, 2f-h)
數據:UV-Vis光譜監測PNP在400 nm吸光度下降,偽一級動力學常數隨Au NPs尺寸減小而增加(2.1 nm: 0.2597 min?1; 5.2 nm: 0.04667 min?1; 7.9 nm: 0.02321 min?1)。
研究意義:小尺寸Au NPs更高催化活性歸因于更大比表面積;生物膜固定化系統可重復使用(5循環后效率保持81%),解決納米催化劑回收難題。
有機染料降解數據(來源:Figure 3c, 3f)
數據:CR降解偽一級速率常數:自由QDs為3.7×10?3 min?1,生物膜錨定QDs為14.2×10?3 min?1,共錨定QDs/Au NPs提升至18.6×10?3 min?1。
研究意義:生物膜疏水口袋富集染料分子,Au NPs促進電荷分離,協同增強光催化效率;系統在3循環后保持高活性,顯示魯棒性。
氫生產動態數據(來源:Figure 4c, 4d)
數據:完整系統(生物膜錨定QDs+工程化氫酶菌株)在8小時光照下產氫達37.7 μmol/L;光暗循環實驗顯示氫濃度在光照期增加,黑暗期穩定或略降。
研究意義:證實半人工光合作用系統的可行性;Unisense電極提供實時監測數據,揭示反應動力學和可逆性。
納米物體負載量數據(來源:Supplementary Fig. 9)
數據:生物膜對5.2 nm Au NPs的負載容量為30.4 μg/mg(濕生物膜)。
研究意義:量化固定化能力,為系統優化提供參數;高負載量確保催化活性位點充足。
熒光猝滅數據(來源:Supplementary Fig. 18)
數據:共錨定QDs/Au NPs的系統熒光發射減弱、衰減加速。
研究意義:表明Au NPs作為電子受體促進電荷分離,直接支持光催化機制。
研究結論
本研究得出以下核心結論:
成功構建活體生物膜催化平臺:通過基因工程生物膜固定納米物體,實現了PNP還原、染料降解和光驅動產氫,系統具有可擴展、可調諧和可重復使用特性。
固定化機制有效:His標簽和配位化學確保納米物體穩定錨定,生物膜基質提供保護層,減少納米毒性對細胞的損傷。
協同效應增強催化:如Au NPs與QDs共固定利用電荷分離提升染料降解效率;生物膜疏水區域富集底物,提高局部反應速率。
實際應用潛力:生物膜的自再生和環境響應性為可持續催化提供新途徑,尤其在廢水處理和能源領域。
丹麥Unisense電極測量數據的詳細解讀
在光驅動產氫實驗中,丹麥Unisense H?微傳感器(型號H2-N)用于實時監測反應液中氫氣的濃度動態變化,其研究意義主要體現在:
實時原位監測:Unisense傳感器具有高靈敏度(檢測限低至微摩爾級),能直接插入反應液(如青霉素小瓶)中連續監測H?濃度(Figure 4c-d),無需取樣擾動反應系統。這提供了動態產氫曲線,準確捕捉反應啟動、峰值和平臺期。
量化催化效率:數據直接顯示產氫速率和總量(如37.7 μmol/L in 8 h),用于比較不同系統(如完整系統vs.缺失組分的對照)的性能差異,證實生物膜QDs與氫酶菌株的協同作用。
揭示反應可逆性:在光暗循環實驗中(Figure 4d),Unisense數據顯示光照期H?濃度上升,黑暗期穩定或略降(因氫酶可逆氧化H?),表明系統存在動態平衡,為優化光照策略提供依據。
技術可靠性:Unisense系統的微電極設計(尖端尺寸小)確保快速響應和最小侵入性,數據通過多通道集線器記錄,保證高信噪比和可重復性。沒有此實時監測,產氫動力學的細微變化(如光暗切換效應)將難以捕捉。
研究意義延伸:Unisense數據驗證了半人工光合作用系統的可行性,強調活體組件(如工程菌)的代謝貢獻,為耦合生物-無機系統設計提供關鍵參數。其高時間分辨率(秒級)支持機制研究,如氫酶活性評估。
總之,丹麥Unisense電極數據是本產氫實驗的核心,通過提供原位、定量H?監測,它不僅證實了催化效率,還揭示了系統動態行為,為活體催化平臺的優化和放大應用奠定了實證基礎。