熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Hydrogen-based syntrophy in an electrically conductive biofilm anode
導電生物膜陽極中基于氫的合成
來源:《Chemical Engineering Journal》(2019年,第359卷)
論文總結
研究通過實驗和理論分析,深入探究了以丁酸鹽(n-butyrate)為底物的混合培養生物膜陽極中氫基互養作用(hydrogen-based syntrophy)與生物膜電導率的關系,揭示了電流產生的限制因素和微生物群落動態。以下是對論文的詳細總結。
摘要概括
摘要指出,丁酸鹽是外產電菌(exoelectrogens)最差的底物之一,但在以丁酸鹽喂養的生物膜陽極中,發現了高電導率(0.67 mS/cm)和顯著的氫基互養作用。溶解氫(H?)濃度隨電流增加而減少,表明H?在互養過程中被消耗。產乙酸菌(acetogens)如Sphaerochaeta和Treponema是主要的H?消費者,而Geobacter是優勢外產電菌。通過2-13C穩定同位素探測量化了產甲烷途徑,與微生物群落變化一致。研究證實,盡管生物膜具有高電導率,但細胞內電子傳輸是電流產生的主要限制因素,而非細胞外電子傳輸。
研究目的
本研究旨在解決以下核心問題:
揭示以丁酸鹽為底物的生物膜陽極中微生物互養相互作用(尤其是氫基互養)的機制和重要性。
量化生物膜的電導率,評估其對電流產生的影響,并識別電流限制步驟。
通過原位測量溶解氫濃度,驗證H?的生產和消耗在互養過程中的作用。
分析微生物群落結構,確定關鍵功能菌群(如外產電菌、產乙酸菌)的角色。
為優化微生物電化學細胞(MxCs)性能提供理論依據,特別是在處理發酵性底物時。
研究思路
研究采用多裝置實驗和多參數監測的系統策略:
實驗設計:使用四種微生物電化學細胞(MxC-1至MxC-4)進行實驗。MxC-1用于監測電流和揮發性脂肪酸(VFA)變化;MxC-2用于原位測量溶解氫濃度;MxC-3用于測量生物膜電導率;MxC-4用于測試H?作為電子供體的效果。所有MxCs在25°C下運行,陽極電位設定為-0.2 V vs. SHE。
參數監測:定期測量電流密度、VFA濃度(如丁酸鹽、乙酸)、溶解氫濃度(使用丹麥Unisense微電極)、生物膜電導率(使用兩探針法),并進行微生物群落分析(16S rRNA測序)。
動力學和熱力學分析:通過熱力學計算閾值H?濃度,評估丁酸鹽發酵的可行性;通過動力學模型分析電流產生限制步驟。
微生物分析:采集生物膜和懸浮細胞樣品,進行DNA提取和高通量測序,解析群落結構和功能。
數據關聯:將化學參數、電化學數據和微生物數據結合,闡釋互養機制和電流產生效率。
測量數據及其研究意義
以下列出關鍵測量數據、其來源(圖/表編號)及研究意義:
電流密度和VFA濃度數據(來源:Fig. 2)
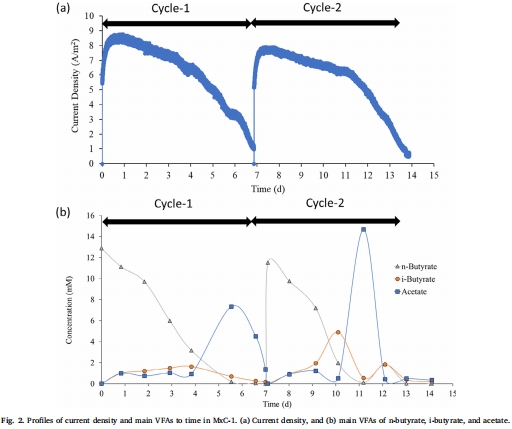
數據:電流密度峰值達7.8-8.8 A/m2,丁酸鹽濃度逐漸減少,間歇性積累異丁酸鹽(i-butyrate)和乙酸(acetate)。
研究意義:表明丁酸鹽通過氧化產乙酸過程發酵產生H?和乙酸,但該過程熱力學不利,需要低H?分壓來驅動,證實了互養相互作用的重要性。
閾值H?濃度計算數據(來源:Fig. 3)
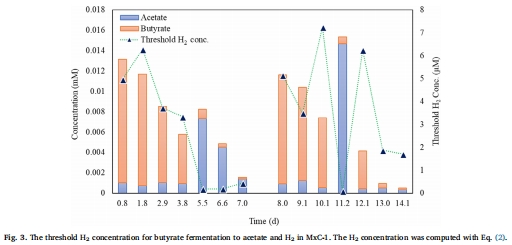
數據:基于熱力學方程計算,閾值H?濃度范圍為0.1-7.2 μM(對應H?分壓10-942 Pa)。
研究意義:提供了丁酸鹽發酵所需的最大H?濃度理論值,驗證了H?消耗的必要性,否則發酵無法進行。
溶解氫濃度數據(來源:Fig. 5,使用丹麥Unisense微電極測量)
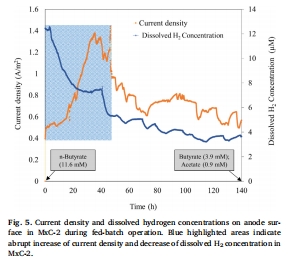
數據:溶解H?濃度初始達12.4 μM,隨電流增加降至3.5 μM;電流急劇增加時,H?濃度驟降。
研究意義:直接證明H?的生產和消耗與電流生成同步,支持氫基互養機制——H?由產酸菌產生,被產乙酸菌消耗,從而促進外產電菌利用乙酸產電。
生物膜電導率數據(來源:Fig. 6)
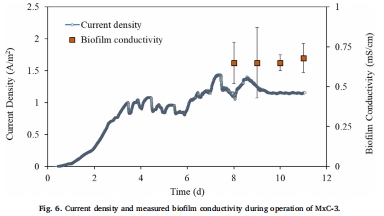
數據:生物膜電導率為0.67 ± 0.14 mS/cm,基于MxC-3測量。
研究意義:表明生物膜具有高電導率,細胞外電子傳輸(EET)不是電流限制因素;計算顯示EET可支持高達30 A/m2的電流,但實際電流較低,提示細胞內電子傳輸是瓶頸。
微生物群落數據(來源:Fig. 4)
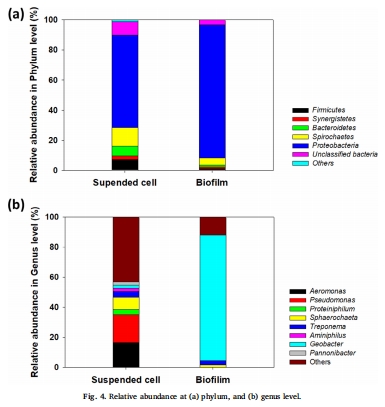
數據:生物膜中Geobacter占主導(83.6%),同時存在Sphaerochaeta和Treponema(產乙酸菌);懸浮細胞中Pseudomonas和Aeromonas豐富。
研究意義:證實微生物互養網絡:Geobacter作為外產電菌,依賴產乙酸菌消耗H?以維持低H?分壓,使丁酸鹽發酵可行。群落結構支持氫基互養假設。
血清瓶測試數據(來源:Table 1)

數據:無陽極呼吸時,丁酸鹽降解緩慢,H?產量低(0.14 mL),且72小時后停止。
研究意義:強調陽極呼吸(電流產生)對驅動丁酸鹽發酵的關鍵作用;缺乏外產電菌時,互養中斷,發酵停滯。
研究結論
本研究得出以下核心結論:
丁酸鹽喂養的生物膜陽極具有高電導率(0.67 mS/cm),但電流密度較低(<2 A/m2),表明細胞內電子傳輸是主要限制步驟,而非細胞外電子傳輸。
氫基互養作用至關重要:丁酸鹽發酵產生H?和乙酸,產乙酸菌(如Sphaerochaeta和Treponema)消耗H?,維持低H?分壓,使熱力學不利的發酵得以進行;Geobacter作為主要外產電菌,利用乙酸產電。
原位溶解氫測量證實H?的生產和消耗動態與電流生成相關,支持互養模型。
微生物群落分析顯示互養伙伴的共存,但直接種間電子轉移(DIET)可能發生,但H?基互養在能量上更有利。
總體,研究強調了在發酵性底物處理中,優化互養相互作用對提高MxCs性能的重要性。
丹麥Unisense電極測量數據的詳細解讀
在本研究中,使用丹麥Unisense微電極系統(H?-100微傳感器)測量溶解氫濃度數據(Fig. 5)具有關鍵作用,其研究意義主要體現在:
提供了原位、高分辨率的氫動態證據:Unisense微電極能夠實時、原位測量生物膜附近的溶解氫濃度(檢測限0.3 μM),避免了取樣擾動。數據顯示H?濃度從12.4 μM降至3.5 μM,且與電流變化同步(電流增加時H?驟降),這直接捕獲了H?生產和消耗的瞬時動態,為氫基互養提供了最直接的實驗證據。
驗證了熱力學計算和互養機制:閾值H?濃度計算(Fig. 3)預測丁酸鹽發酵需要低H?分壓(<7.2 μM)。Unisense數據證實H?濃度始終低于閾值,且消耗迅速,表明產乙酸菌作為H?清除者有效維持了低H?環境,使丁酸鹽發酵在熱力學上可行。這連接了理論預測和實際生物過程,增強了機制的可信度。
揭示了電流產生與H?代謝的耦合:H?濃度變化與電流密度曲線高度相關——電流峰值對應H?消耗峰值,表明H?消耗驅動了乙酸生產,進而促進外產電菌產電。這證明了微生物互養網絡的功能:產酸菌產生H?,產乙酸菌消耗H?產生乙酸,外產電菌利用乙酸產電。
排除了其他H?消耗途徑:通過MxC-4實驗,H?作為直接電子供體時電流可忽略(0.03-0.24 A/m2),且無甲烷檢測,表明H?不是由產甲烷菌或外產電菌直接氧化,而是由產乙酸菌主導消耗。Unisense數據支持了這一結論,因為H?消耗與乙酸積累同步。
技術優勢確保數據可靠性:Unisense微電極的高精度和原位測量能力避免了傳統方法(如氣相色譜)的延遲和采樣誤差,提供了連續、真實的H?濃度數據。這使研究者能精確量化H?通量,并關聯微生物活動。
總之,丹麥Unisense電極數據不僅是測量工具,更是揭示微生物互養機制的關鍵。它通過提供原位H?濃度動態,令人信服地證明了氫基互養在丁酸鹽降解生物膜中的核心作用,為優化MxCs提供了深入見解。如果沒有這些數據,互養假設將缺乏直接證據,研究結論將較弱。