熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Hydrogen-based syntrophy in an electrically conductive biofilm anode
導電生物膜陽極中基于氫的合成
來源:Chemical Engineering Journal 359 (2019) 208–216
摘要概括
摘要指出,研究團隊在一個以正丁酸為底物的生物膜陽極中,發現了高達 0.67 mS/cm 的電導率,證明胞外電子傳遞并非電流密度的限制因素。研究證實了 基于氫氣的互養關系 在該導電生物膜中起著關鍵作用:丁酸通過氧化產乙酸作用被降解為乙酸和氫氣,而生成的氫氣又被產乙酸菌(如 Sphaerochaeta和 Treponema)消耗,從而驅動熱力學上不利的丁酸降解反應。通過使用丹麥Unisense微電極進行的原位監測,直接證實了在電流產生過程中生物膜內存在氫氣的產生(最高達12.4μM)和消耗。這表明,即使生物膜是導電的,氫基互養對于丁酸的利用仍然至關重要。
研究目的
本研究主要有四個目的:
證明互養作用:驗證在利用丁酸的微生物電化學系統中,發酵菌、氫氣消耗者和產電菌之間協同互養關系的必要性。
驗證互養機制:通過熱力學分析、分子生物學技術和溶解氫濃度的實驗測量,證實與閾值氫氣濃度相關的互養作用。
闡明降解路徑:明確丁酸在生物膜陽極中的降解途徑。
識別限速步驟:量化生物膜的電導率,以評估電流密度的限制環節是發生在細胞內部(微生物互養代謝)還是細胞外部(電子傳遞)。
研究思路
研究團隊設計了四種不同的微生物電化學反應器來達成上述目標:
MxC-1:用于常規運行,監測電流密度和揮發性脂肪酸的變化,驗證丁酸降解模式。
MxC-2:專門用于使用丹麥Unisense氫氣微電極,將電極尖端靠近陽極表面,實時監測溶解氫氣濃度的動態變化,直接證明氫氣的產生與消耗。
MxC-3:采用帶有微小間隙的雙金電極設計,用于直接測量生物膜的電導率。
MxC-4:用于驗證產電菌是否能直接利用氫氣作為電子 donor(結果發現不能)。
此外,還設置了血清瓶實驗(無陽極呼吸)作為對照,并進行了微生物群落分析(高通量測序)以鑒定關鍵菌群。
測量數據及其研究意義
電流密度與揮發性脂肪酸
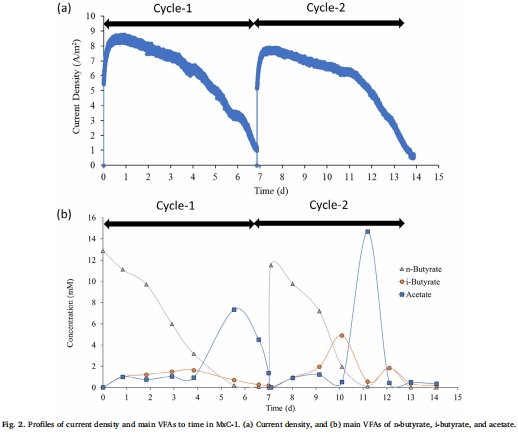
數據來源:圖2 展示了MxC-1中電流密度以及正丁酸、異丁酸和乙酸濃度隨時間的變化曲線。
研究意義:電流的產生與丁酸的消耗同步進行,并伴有異丁酸和乙酸的中間積累和降解。這為丁酸通過氧化產乙酸途徑降解提供了間接證據,暗示了需要氫氣消耗者來維持低氫分壓,驅動熱力學反應。
溶解氫氣濃度
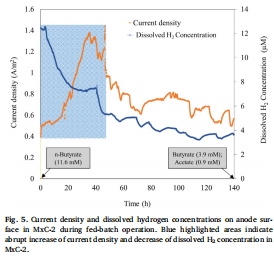
數據來源:圖5 展示了MxC-2中電流密度和陽極表面溶解氫氣濃度的同步變化。
研究意義:這是本研究的關鍵發現之一。它首次直接證實了在電流產生過程中,生物膜內確實發生了氫氣的產生和消耗。氫氣濃度在電流急劇上升時快速下降,將微生物代謝與電化學活性直接聯系起來,為氫基互養理論提供了最直接的實驗證據。
生物膜電導率
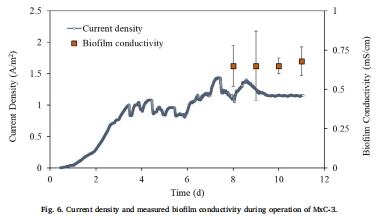
數據來源:圖6 展示了MxC-3中測得的生物膜電導率,穩定在 0.67 ± 0.14 mS/cm。
研究意義:該數值與以乙酸為底物的Geobacter富集生物膜的電導率相當。這表明,盡管底物復雜、涉及多種微生物互養,但生物膜本身具有高度的導電性,胞外電子傳遞并非電流產生的限制因素。計算表明,EET理論可支持高達~30 A/m2的電流密度,遠高于實際觀測值。
微生物群落結構
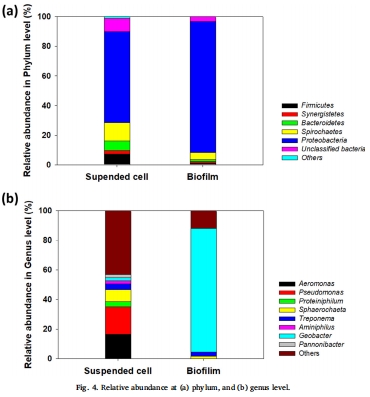
數據來源:圖4 顯示了生物膜和懸浮細胞在門水平和屬水平的群落組成。
研究意義:測序結果顯示,生物膜中Geobacter(83.6%) 占絕對主導,同時存在已知的產乙酸菌屬 Sphaerochaeta 和 Treponema。這從微生物組成上支持了Geobacter(產電菌)與產乙酸菌(氫氣消耗者)之間互養關系的假說。
血清瓶實驗數據

數據來源:表1 列出了在無陽極呼吸的血清瓶中,72小時后各脂肪酸和沼氣的濃度變化。
研究意義:在沒有陽極作為最終電子受體的條件下,丁酸降解和氫氣產生很快停止。這反證了產電菌通過陽極呼吸消耗乙酸,對于維持整個互養鏈條的持續運轉至關重要。
研究結論
本研究得出以下核心結論:
在以丁酸為底物的生物膜陽極中,存在一種由產電菌(Geobacter)、發酵菌和產乙酸菌(氫氣消耗者)構成的氫基互養關系,這是驅動丁酸有效降解和產電的關鍵。
盡管該生物膜具有高導電性(0.67 mS/cm),表明直接種間電子傳遞可能存在,但實驗數據強有力地證明了氫基互養在其中扮演著不可或缺的角色。
電流密度的主要限制因素并非胞外電子傳遞,而是細胞內/細胞間的電子傳遞過程,即涉及丁酸發酵、氫氣消耗和乙酸氧化的復雜微生物代謝動力學。
丹麥Unisense電極測量數據的詳細解讀
使用丹麥Unisense氫氣微電極進行原位測量的數據(圖5)具有重要的研究意義:
提供了直接證據,打破了間接推論的局限:過去關于生物膜陽極中互養作用的研究,大多依賴于末端產物分析和微生物群落測序等間接證據。本研究通過高精度微電極直接捕捉到氫氣濃度的動態變化,將“黑箱”中的微觀代謝過程以定量數據的形式呈現出來,使氫基互養從“假說”變為“可觀測的現象”。
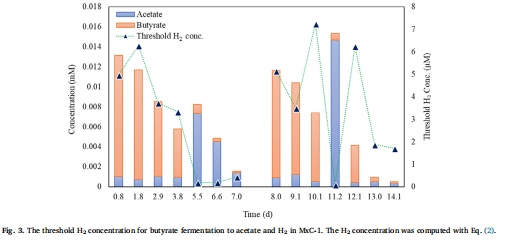
將熱力學理論與實驗數據完美銜接:研究前期通過熱力學計算(圖3)預測了驅動丁酸發酵所需的閾值氫氣濃度(0.1-7.2μM)。Unisense電極測量到的氫氣濃度(最高12.4μM,隨后降至3.5μM)與理論計算的閾值高度吻合。這不僅驗證了熱力學分析的準確性,也證明了微生物生態系統確實通過高效的氫氣消耗,將氫分壓維持在允許丁酸降解的熱力學窗口內。
揭示了代謝與電化學活性的實時耦合關系:圖5中藍色高亮區域顯示,電流密度的急劇上升與溶解氫氣濃度的驟降在時間上高度同步。這一現象清晰地表明,氫氣被消耗的過程(很可能是產乙酸菌將其轉化為乙酸)直接為產電菌(Geobacter)提供了更易利用的底物(乙酸),從而迅速提升了電流輸出。這直觀地展示了不同微生物功能群在時間和空間上的協同作用。
為優化系統性能指明方向:該測量結果證實,即使在高導電生物膜中,氫氣介導的代謝途徑仍是瓶頸。因此,要提升利用復雜底物(如丁酸)的微生物電化學系統的性能,未來的研究重點應放在如何優化和加速這種微生物互養代謝網絡上,例如,通過調控群落結構或環境條件來促進氫氣的高效循環,而不是僅僅關注生物膜的導電性。
總之,丹麥Unisense電極的應用為本研究提供了最關鍵的直接證據,極大地增強了對生物膜陽極中復雜微生物互養過程的理解深度和說服力。