熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Differential expression of the five redox complexes in the retinal mitochondria or rod outer segment disks is consistent with their different functionality
視網膜線粒體或視桿外段盤中五種氧化還原復合物的差異表達與它們的不同功能一致
來源:FASEB BioAdvances. 2020;2:315–324.
1. 論文摘要核心內容
本研究通過蛋白質組學與功能分析,揭示了視網膜桿狀外節(OS)盤膜(無傳統線粒體)進行氧化磷酸化(OxPhos)的分子機制:
關鍵發現:OS盤表達完整的氧化磷酸化蛋白復合物(ETC復合物I-V),其底物利用譜(如檸檬酸、NADH)與線粒體顯著不同(表1、表2)。
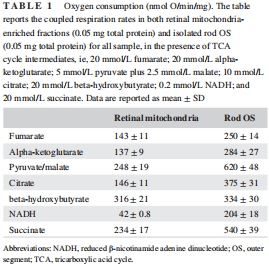
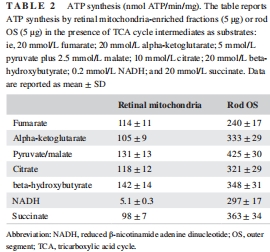
功能差異:OS盤對多種底物(如丙酮酸/蘋果酸)的氧消耗(250–620 nmol O?/min/mg)和ATP合成(240–425 nmol ATP/min/mg)能力高于線粒體(表1、表2)。
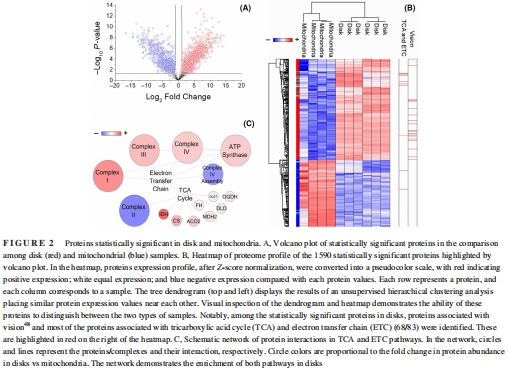
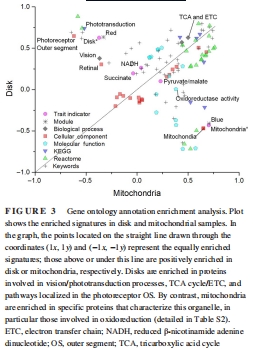
分子基礎:蛋白質組學(LC-MS/MS)鑒定出OS盤特異性富集TCA循環(68/83種蛋白)和ETC復合物(如復合物I亞基ND1)(圖2C),而線粒體富集復合物IV組裝因子(如SCO1、SURF1)。
意義:OS盤的氧化磷酸化能力獨立于線粒體,可能為光轉導提供即時ATP,并為視網膜退行性疾病提供新機制視角。
2. 研究目的
1.明確OS盤(無傳統線粒體)進行高效氧化磷酸化的分子基礎。
2.對比OS盤與視網膜線粒體的蛋白表達譜與功能差異,驗證OxPhos蛋白是否為OS盤的固有組分。
3.探究OS盤氧化磷酸化在視網膜能量代謝與疾病中的病理生理意義。
3. 研究思路
1.樣本制備:
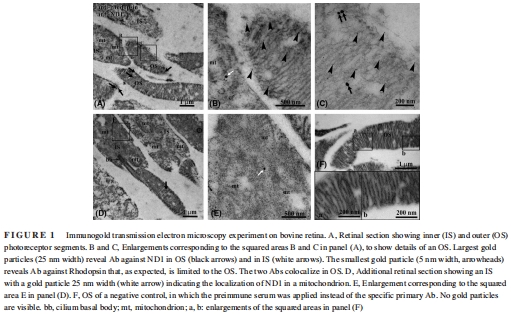
純化牛視網膜OS盤和線粒體,通過Western blot(RHO/ACOX2標記)和電鏡(圖1)驗證純度。
2.功能驗證:
氧消耗與ATP合成:測量OS盤和線粒體對7種底物(如琥珀酸、NADH)的呼吸活性(表1、表2)。
關鍵數據:OS盤對NADH的氧消耗(204±18 nmol/min/mg)顯著高于線粒體(42±0.8),ATP合成能力高58倍(表2)。
3.蛋白質組學:
LC-MS/MS鑒定3383種蛋白,OS盤特異性富集1171種(如TCA/ETC蛋白),線粒體富集448種(如復合物IV組裝因子)。
4.生物信息學:
WGCNA分析:紅色模塊(OS盤)與TCA/ETC蛋白強相關(r>0.7),藍色模塊(線粒體)與丙酮酸/蘋果酸利用相關。
差異表達:火山圖顯示957種蛋白在OS盤富集(含68種TCA/ETC蛋白),633種在線粒體富集(圖2A)。
5.功能注釋:
GO分析證實OS盤富集“視覺轉導”“TCA循環”“ETC”通路,線粒體富集“氧化還原”(圖3)。
4. 關鍵數據及研究意義
(1) 氧消耗與ATP合成(表1、表2)
數據:OS盤對丙酮酸/蘋果酸的氧消耗(620±48 nmol/min/mg)和ATP合成(425±30 nmol/min/mg)均高于線粒體(248±19;131±13)。
意義:直接證明OS盤具有獨立于線粒體的高效OxPhos能力,為光轉導高能量需求提供支撐。
(2) 蛋白質組差異(圖2)
數據:
OS盤富集IDH3(TCA限速酶)、復合物I亞基(ND1)、ATP合酶亞基(MT-ATP6/8)。
線粒體富集復合物IV組裝因子(SCO1、SURF1)。
意義:OS盤的OxPhos蛋白非污染物,而是功能組分;其缺乏組裝因子提示蛋白可能由線粒體合成后轉運至OS盤。
(3) 功能模塊分析
數據:WGCNA紅色模塊(OS盤)與多種底物利用強相關(r=0.58–0.74),藍色模塊(線粒體)僅與丙酮酸/蘋果酸相關(r=0.71)。
意義:OS盤具有更廣的底物適應性,可能適應光轉導的動態能量需求。
5. 結論
1.OS盤是獨立氧化磷酸化單元:表達完整ETC復合物和TCA酶,高效產生ATP(非線粒體依賴)。
2.功能分化:OS盤偏好多種底物(如NADH、琥珀酸),線粒體依賴丙酮酸/蘋果酸。
3.病理意義:OS盤OxPhos異常可能導致氧化應激(如藍光照射),參與視網膜退行疾病(如糖尿病視網膜病變)。
6. 丹麥Unisense電極的核心價值
(1) 技術應用場景
實時氧消耗監測:
使用Unisense微呼吸系統(方法2.1.2)測量純化OS盤在封閉腔室中的氧分壓動態變化(精度達nmol O?/min/mg)。
功能驗證:
直接量化OS盤對7種底物的呼吸活性(表1),為蛋白質組數據提供功能佐證。
(2) 科學意義
高靈敏度與實時性:
Unisense電極的微米級探頭和毫秒級響應可檢測低至42 nmol O?/min/mg的呼吸速率(表1),精準捕捉OS盤的微弱氧耗。
跨尺度驗證:
電極數據與蛋白質組(ETC蛋白富集)、功能測定(ATP合成)形成三位一體證據鏈,確證OS盤的OxPhos能力。
排除污染假說:
電極證實OS盤呼吸活性獨立于線粒體(如對NADH的高響應性),排除“線粒體污染”爭議。
(3) 研究啟示
技術優勢:
相比傳統克拉克電極,Unisense的無創微測避免樣本破壞,適用于微量樣本(0.04 mg蛋白)。
疾病模型價值:
電極可監測病理條件下(如糖尿病)OS盤氧代謝變化,為氧化應激致視網膜損傷提供動態指標。
總結
本研究通過Unisense電極的精準氧監測,結合蛋白質組學與生物信息學,首次揭示:
1.OS盤是氧化磷酸化新場所:獨立于線粒體,富集ETC/TCA蛋白(圖2),高效利用多種底物(表1,2)。
2.功能進化意義:為光轉導高能量需求提供“就地供能”策略,避免ATP長距離運輸。
3.疾病關聯:OS盤OxPhos異常可能通過氧化應激(如ROI產生)誘發視網膜退行病變,為治療靶點提供新方向。
Unisense電極的核心貢獻在于:
功能定量:直接驗證OS盤的呼吸活性,支撐“無線粒體的OxPhos”這一顛覆性概念。
技術不可替代性:其高靈敏度與實時動態監測能力,為亞細胞器代謝研究樹立新標桿。