熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
The passage from bone marrow niche to bloodstream triggers the metabolic impairment in Fanconi Anemia mononuclear cells
從骨髓生態(tài)位到血流的通道觸發(fā)了范可尼貧血單核細胞的代謝障礙
來源:Redox Biology 36 (2020) 101618
1. 論文摘要核心內容
研究揭示了 范可尼貧血(FA)骨髓單核細胞(MNCs)從骨髓(BM)微環(huán)境進入血液后發(fā)生代謝崩潰的機制:
核心發(fā)現(xiàn):
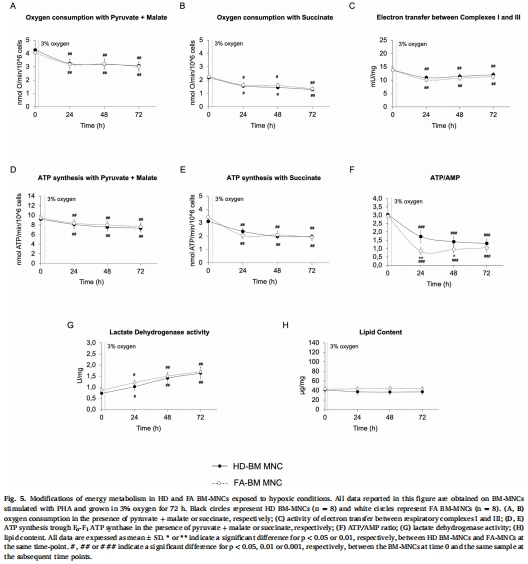
缺氧保護效應:FA細胞在BM低氧環(huán)境(3% O?)中代謝正常(依賴無氧糖酵解),與健康細胞無差異(圖1, 圖5-6)。
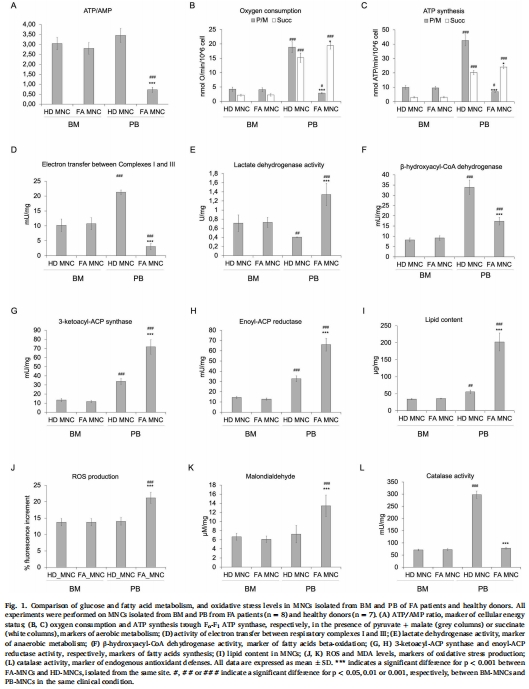
常氧觸發(fā)崩潰:進入血液(20% O?)后,F(xiàn)A細胞線粒體呼吸鏈復合物I-III電子傳遞缺陷(圖1D, 圖2C),導致:
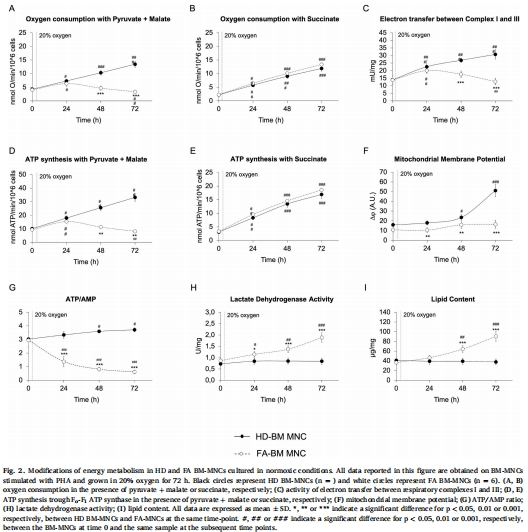
有氧代謝障礙(耗氧量↓、ATP合成↓)(圖1B-C, 圖2A,D)。
無氧糖酵解代償性增強(乳酸脫氫酶↑)(圖1E, 圖2H)。
脂質積累(圖1I, 圖2I)。
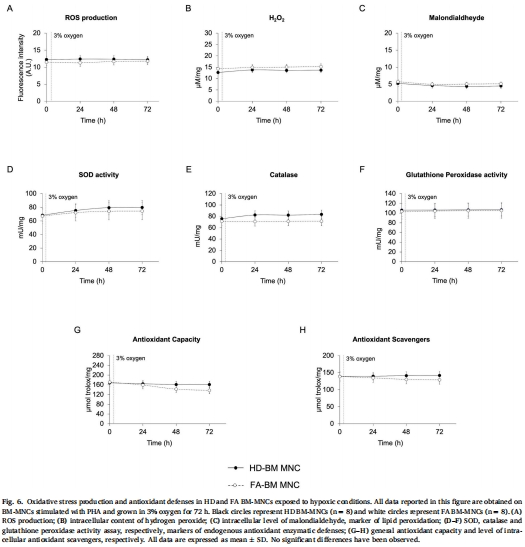
氧化應激激增(ROS↑、H?O?↑、脂質過氧化↑)(圖1J-K, 圖4A-C)。
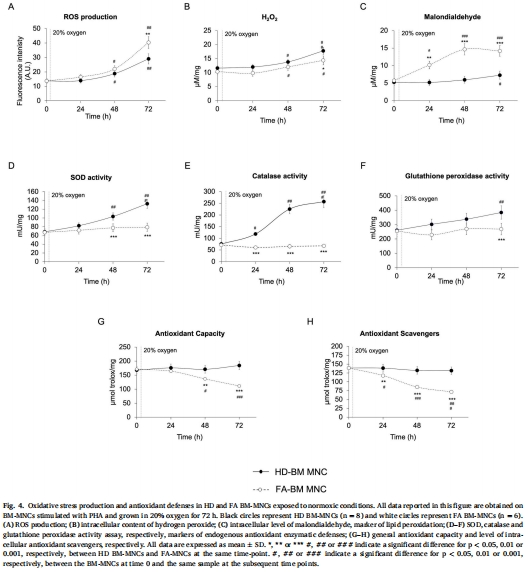
抗氧化防御失活(SOD/過氧化氫酶/谷胱甘肽過氧化物酶活性↓)(圖1L, 圖4D-F)。
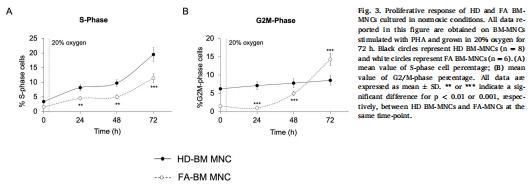
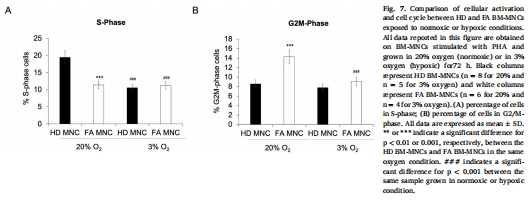
G2/M細胞周期阻滯(圖3B, 圖7B)。
機制核心:氧濃度升高暴露FA細胞線粒體缺陷,導致代謝-氧化應激惡性循環(huán)。
臨床意義:解釋FA骨髓衰竭(BMF)的誘因,為靶向微環(huán)境的治療提供依據(jù)。
2. 研究目的
闡明 FA細胞代謝缺陷的時空特異性(為何僅在血液中顯現(xiàn))。
驗證 氧濃度變化(BM缺氧→血液常氧)是觸發(fā)FA代謝崩潰的關鍵因素。
揭示 代謝-氧化應激失衡與FA骨髓衰竭(BMF)的因果關系。
3. 研究思路
1.樣本設計:
FA患者 vs 健康供體(HD):BM和血液來源的MNCs(圖1)。
體外模擬微環(huán)境:
缺氧(3% O?):模擬BM微環(huán)境(圖5-6)。
常氧(20% O?):模擬血液環(huán)境(圖2-4)。
2.代謝應激模型:
植物血凝素(PHA)刺激細胞增殖,模擬細胞離開BM后的活化狀態(tài)(圖2-7)。
3.多維度檢測:
能量代謝(耗氧量、ATP合成、糖酵解)。
氧化應激(ROS、脂質過氧化)。
抗氧化防御(SOD、過氧化氫酶等)。
細胞周期分析。
4. 關鍵數(shù)據(jù)及研究意義
(1) BM與血液MNCs代謝對比(圖1)
數(shù)據(jù):
血液FA-MNCs:ATP/AMP↓(圖1A)、復合物I-III電子傳遞↓(圖1D)、耗氧量↓(圖1B)、乳酸脫氫酶↑(圖1E)、脂質積累↑(圖1I)、ROS↑(圖1J)、抗氧化酶↓(圖1L)。
BM FA-MNCs:與HD無差異(所有指標)。
意義:首次證實FA代謝缺陷僅存在于血液微環(huán)境,揭示BM缺氧的保護作用。
(2) 常氧暴露動態(tài)崩潰(圖2)
數(shù)據(jù):
0-24小時:FA細胞試圖激活有氧代謝(耗氧量短暫↑)(圖2A)。
48-72小時:復合物I-III功能崩潰(圖2C)、ATP合成↓(圖2D)、糖酵解代償↑(圖2H)。
意義:捕捉FA細胞在常氧下的動態(tài)代償-失代償過程,揭示線粒體缺陷的漸進性惡化。
(3) 氧化應激-抗氧化失衡(圖4)
數(shù)據(jù):
FA細胞:ROS/H?O?/脂質過氧化持續(xù)↑(圖4A-C),但SOD/過氧化氫酶活性無響應(圖4D-E)。
HD細胞:氧化應激↑伴隨抗氧化酶同步↑(平衡狀態(tài))。
意義:FA細胞喪失氧化應激應答能力,導致DNA損傷累積(解釋惡性轉化風險)。
(4) 缺氧維持代謝穩(wěn)態(tài)(圖5-6)
數(shù)據(jù):
缺氧下FA細胞:有氧代謝↓(圖5A-E)、糖酵解↑(圖5G),但代謝指標與HD無差異(圖5-6)。
細胞周期正常(圖7)。
意義:缺氧是FA細胞的“保護傘”,抑制線粒體缺陷暴露。
(5) 細胞周期阻滯(圖3,7)
數(shù)據(jù):常氧下FA細胞G2/M期阻滯↑(圖3B),缺氧下解除(圖7B)。
意義:代謝崩潰直接導致細胞分裂障礙,解釋BMF的細胞學基礎。
5. 研究結論
1.微環(huán)境決定代謝命運:BM缺氧掩蓋FA線粒體缺陷,血液常氧觸發(fā)全面崩潰。
2.惡性循環(huán)機制:
線粒體復合物I-III缺陷 → 有氧代謝障礙 → 糖酵解代償 → 氧化應激↑。
抗氧化防御失活 → 氧化損傷累積 → DNA修復失敗 → 細胞周期阻滯/惡性轉化。
3.BMF新解釋:血液中FA細胞周期性死亡→BM干細胞過度動員→耗竭→骨髓衰竭。
6. 丹麥Unisense電極的核心價值
(1) 技術優(yōu)勢
高精度耗氧率(OCR)監(jiān)測:
使用Unisense微呼吸儀(圖1B, 圖2A-B, 圖5A-B)實時測量細胞耗氧量。
空間分辨率:沿細胞短軸4點測量(1/16, 1/8, 1/4, 1/2),反映代謝異質性。
功能分化檢測:
底物特異性:
丙酮酸/蘋果酸 → 激活復合物I途徑(圖1B, 2A)。
琥珀酸 → 激活復合物II途徑(圖1B, 2B)。
結果:FA細胞僅復合物I途徑缺陷(圖2A vs 2B),精準定位電子傳遞鏈斷裂點。
(2) 關鍵發(fā)現(xiàn)
1.動態(tài)代謝軌跡捕捉:
揭示FA細胞在常氧下“短暫代償→崩潰”的耗氧動態(tài)(圖2A),這是靜態(tài)檢測(如WB)無法實現(xiàn)的。
2.微環(huán)境氧壓量化:
證實BM缺氧(3% O?)抑制有氧代謝,使FA細胞維持“無癥狀狀態(tài)”(圖5)。
3.治療啟示:
數(shù)據(jù)表明:維持BM低氧或靶向復合物I缺陷可緩解FA代謝崩潰(如使用復合物II底物琥珀酸)。
(3) 研究意義
機制深度:直接證明氧濃度是FA代謝缺陷的“開關”,顛覆傳統(tǒng)認知。
技術不可替代性:Unisense電極是唯一能實時、原位監(jiān)測細胞耗氧動態(tài)的工具,為代謝疾病研究提供金標準。
臨床轉化:為開發(fā)“模擬缺氧”療法(如缺氧誘導劑)或靶向復合物I的藥物提供依據(jù)。
核心圖示:FA細胞代謝崩潰機制
BM缺氧(3% O?) → 無氧糖酵解 → 代謝穩(wěn)態(tài)
↓
進入血液(20% O?) → 線粒體復合物I-III激活失敗 → 有氧代謝障礙
↓
糖酵解代償 ↑ + 氧化應激 ↑ + 抗氧化防御 ↓
↓
DNA損傷 + 細胞周期阻滯 → 骨髓衰竭/惡性轉化
總結:
本研究通過整合 Unisense電極耗氧監(jiān)測、代謝組學及細胞功能分析,首次揭示氧濃度升高是觸發(fā)FA細胞代謝崩潰的關鍵因素。丹麥Unisense電極的 高時空分辨率耗氧動態(tài)數(shù)據(jù) 為“缺氧保護-常氧崩潰”理論提供了不可替代的直接證據(jù),不僅闡明FA骨髓衰竭的代謝根源,也為靶向微環(huán)境的治療策略開辟新途徑。