熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Epithelial-Derived Reactive Oxygen Species Enable AppBCX-Mediated Aerobic Respiration of Escherichia coli during Intestinal Inflammation
上皮衍生的活性氧能夠在腸道炎癥期間實現(xiàn) AppBCX 介導(dǎo)的大腸桿菌有氧呼吸
來源:Chanin et al., 2020, Cell Host & Microbe 28, 780–788
1. 論文摘要核心內(nèi)容
研究發(fā)現(xiàn)腸道炎癥期間,上皮細胞產(chǎn)生的活性氧(ROS)可被大腸桿菌(E. coli)的AppBCX酶系統(tǒng)利用:
核心機制:宿主NADPH氧化酶1(NOX1)產(chǎn)生的ROS(如H?O?)被大腸桿菌過氧化氫酶(KatE/KatG)降解為氧氣,進而支持AppBCX介導(dǎo)的有氧呼吸(圖2A)。
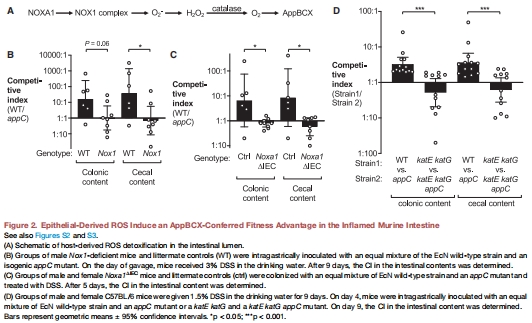
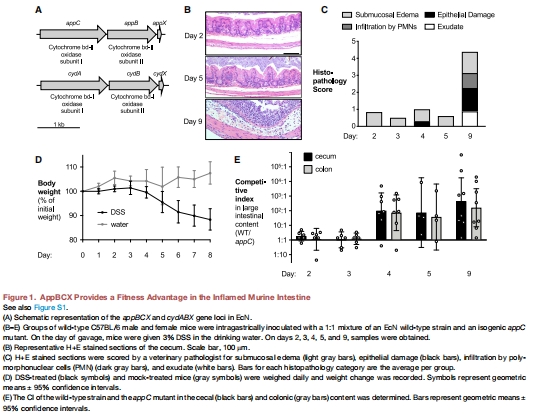
生理意義:在化學(xué)性結(jié)腸炎(DSS模型)和遺傳性結(jié)腸炎(IL-10?/?模型)中,AppBCX賦予大腸桿菌生長優(yōu)勢(圖1E, 4E),而這一優(yōu)勢在NOX1缺陷小鼠中消失(圖2B-C)。
創(chuàng)新點:揭示了宿主免疫反應(yīng)(ROS釋放)意外促進病原體生長的“悖論”,為炎癥性腸病(IBD)中菌群失調(diào)提供了新解釋。
2. 研究目的
探究炎癥環(huán)境下宿主ROS如何重塑腸道微生物代謝,重點驗證:
宿主上皮細胞產(chǎn)生的ROS是否通過轉(zhuǎn)化為氧氣,支持大腸桿菌的AppBCX依賴性有氧呼吸?
旨在闡明炎癥相關(guān)菌群失調(diào)(如Enterobacteriaceae富集)的代謝基礎(chǔ)。
3. 研究思路
1.模型構(gòu)建:
體內(nèi):
DSS結(jié)腸炎模型:野生型(WT)與NOX1缺陷小鼠(圖2B-C)。
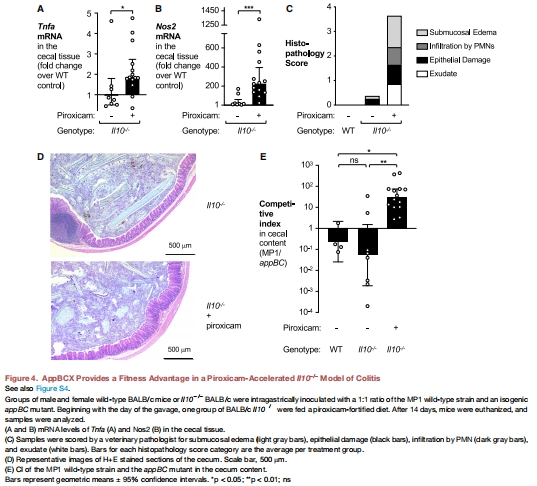
遺傳模型:IL-10?/?小鼠加速結(jié)腸炎(圖4)。
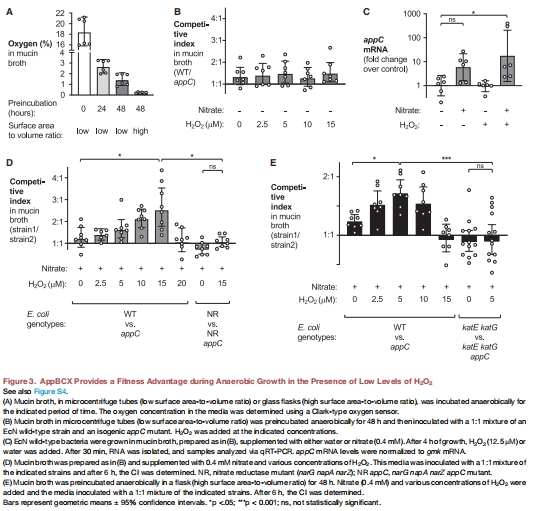
體外:模擬腸道環(huán)境的黏蛋白培養(yǎng)基(Mucin Broth),調(diào)控氧氣與H?O?水平(圖3)。
2.細菌基因操作:
構(gòu)建大腸桿菌(EcN、MP1菌株)的appC、katE、katG單/雙/三基因敲除突變體(圖1A, 圖3D-E)。
3.競爭性定植實驗:
野生型與突變株1:1混合接種小鼠,通過競爭指數(shù)(CI) 量化生長優(yōu)勢(圖1E, 2B-E)。
4.機制驗證:
檢測ROS來源(上皮NOX1依賴,圖2)、氧氣生成(過氧化氫酶依賴,圖3E)、呼吸鏈調(diào)控(ArcAB通路,圖3C)。
4. 關(guān)鍵數(shù)據(jù)及研究意義
(1) AppBCX在炎癥腸道中的生長優(yōu)勢(圖1E, 圖4E)
數(shù)據(jù):
DSS結(jié)腸炎模型中,野生型EcN的CI顯著高于appC突變體(WT小鼠:↑3倍;NOX1缺陷鼠:無差異)。
IL-10?/?結(jié)腸炎模型中,MP1野生型CI高于appBC突變體(↑2.5倍)。
意義:首次證明AppBCX是炎癥環(huán)境下大腸桿菌生長的關(guān)鍵因子。
(2) 上皮NOX1是ROS來源(圖2B-C)
數(shù)據(jù):
NOX1缺陷鼠(Nox1?/?)或上皮特異性NOXA1缺陷鼠(Noxa1????)中,AppBCX的生長優(yōu)勢消失(CI≈1)。
意義:宿主上皮ROS直接驅(qū)動大腸桿菌的呼吸代謝重塑。
(3) H?O?→O?轉(zhuǎn)化支持呼吸(圖3)
數(shù)據(jù):
體外添加H?O?(5–15 μM)增強野生型EcN生長(CI↑),但需過氧化氫酶(katE/katG)參與(圖3E)。
katE katG雙突變體喪失AppBCX優(yōu)勢(體內(nèi)圖2D,體外圖3E)。
意義:ROS解毒為氧氣是AppBCX呼吸的底物來源。
(4) 呼吸鏈調(diào)控依賴ArcAB(圖3C-D)
數(shù)據(jù):
H?O?+硝酸鹽協(xié)同誘導(dǎo)appC轉(zhuǎn)錄(↑4倍),而cydA不變(圖3C)。
硝酸還原酶突變(nar)消除AppBCX優(yōu)勢(圖3D)。
意義:呼吸鏈感應(yīng)系統(tǒng)(ArcAB)整合氧化應(yīng)激與電子受體信號。
5. 丹麥Unisense電極數(shù)據(jù)的核心意義
(1) 技術(shù)實現(xiàn)與方法
設(shè)備:Clark型氧傳感器(Unisense OX-N-14839)實時監(jiān)測培養(yǎng)基溶解氧(方法部分)。
關(guān)鍵數(shù)據(jù):
圖3A:厭氧培養(yǎng)48小時后,不同容器(微管vs燒瓶)的氧氣殘留量(微管:1.5% O?;燒瓶:0.2% O?)。
質(zhì)量控制:通過預(yù)孵育調(diào)控初始氧濃度,模擬腸道缺氧環(huán)境。
(2) 科學(xué)價值
1.揭示物理約束影響氧氣可用性:
微管(低表面積/體積比)保留更多氧氣→支持殘留呼吸(圖3B)。
燒瓶(高表面積/體積比)氧氣接近零→嚴格厭氧(圖3E)。
2.驗證H?O?→O?轉(zhuǎn)化假說:
在超低氧環(huán)境(0.2% O?)中,添加H?O?仍能激活A(yù)ppBCX(圖3E),排除殘留氧氣干擾,確證H?O?降解為O?是關(guān)鍵步驟。
3.量化“氧氣窗口”:
明確0.2–1.5% O?濃度范圍足以觸發(fā)AppBCX呼吸,為體內(nèi)研究提供參考閾值。
(3) 研究意義
不可替代性:傳統(tǒng)方法無法實時監(jiān)測納摩爾級氧氣變化,Unisense電極是鏈接宿主ROS與細菌呼吸代謝的關(guān)鍵工具。
轉(zhuǎn)化價值:為靶向菌群代謝(如抑制AppBCX)干預(yù)IBD提供理論依據(jù)。
6. 研究結(jié)論
1.宿主-微生物互作新范式:宿主炎癥ROS→被細菌解毒為O?→支持病原體有氧呼吸→促進菌群失調(diào)(圖2A)。
2.靶點特異性:AppBCX(而非CydABX)是炎癥環(huán)境下核心呼吸酶,依賴上皮NOX1及細菌過氧化氫酶。
3.治療啟示:抑制AppBCX或阻斷ROS-O?轉(zhuǎn)化或可緩解炎癥相關(guān)菌群失衡。
7. 核心圖示
[炎癥] → [上皮NOX1釋放ROS] → [細菌KatE/KatG將H?O?→O?] → [O?支持AppBCX呼吸] → [大腸桿菌生長優(yōu)勢]
Unisense電極:精準量化O?動態(tài),驗證代謝轉(zhuǎn)化鏈
研究啟示:
Unisense電極技術(shù)通過高分辨率氧監(jiān)測,揭示了宿主-微生物代謝對話的微觀動態(tài),為研究炎癥環(huán)境中微生物呼吸適應(yīng)性設(shè)立了新標準。未來可拓展至其他氣體分子(如NO、H?S)在菌群生態(tài)中的作用研究。