熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Targeting the Acidic Tumor Microenvironment:Unexpected Pro-Neoplastic Effects of Oral NaHCO3 Therapy in Murine Breast Tissue
(pH電極)靶向酸性腫瘤微環境口服NaHCO3小鼠乳腺組織的意外促腫瘤作用
來源:Cancers 2020, 12, 891; doi:10.3390
1. 論文摘要核心內容
研究揭示了口服碳酸氫鈉(NaHCO?)對乳腺癌微環境的矛盾影響:
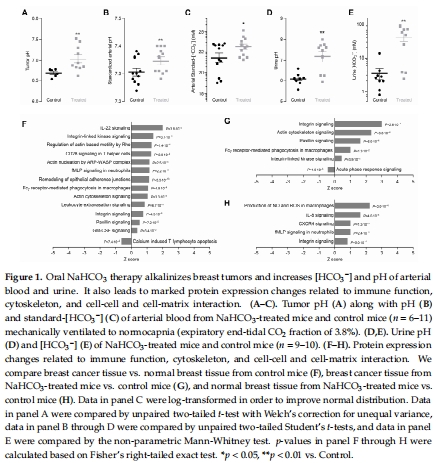
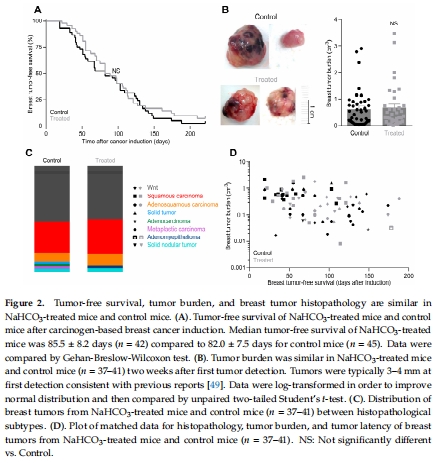
治療使腫瘤pH從6.68升至7.04(圖1A),但未延緩腫瘤發生或抑制生長(圖2A-B)。
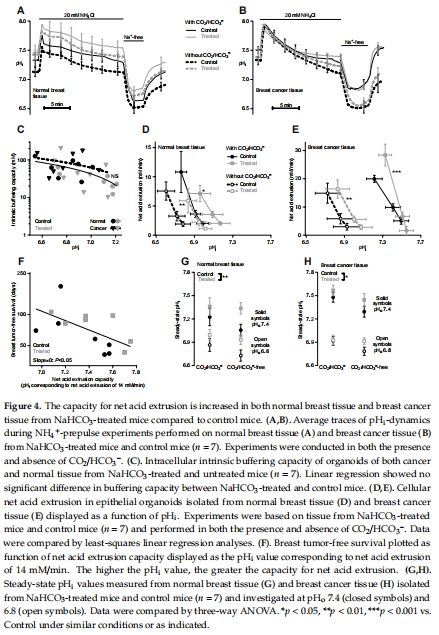
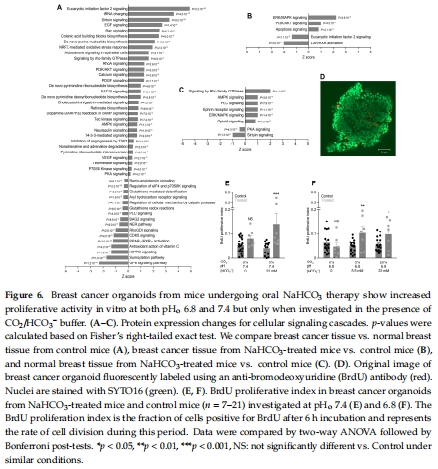
意外發現:治療增強癌細胞凈酸排出能力(圖4D-E)、提高增殖活性(圖6E-F),抵消了堿性微環境的潛在益處。
蛋白質組學顯示治療重塑代謝、細胞信號和免疫相關通路(圖1F-H, 圖3B)。
2. 研究目的
探究口服NaHCO?能否通過中和腫瘤酸性微環境(pH?↓)抑制乳腺癌發展,并闡明其對癌細胞生物學行為的影響。
3. 研究思路
1.動物模型:
致癌物(DMBA)誘導雌性C57BL/6j小鼠乳腺癌。
實驗組:飲用含200 mM NaHCO?的水(治療組);對照組:普通飲水。
2.多尺度分析:
微環境:Unisense電極原位測腫瘤pH?(圖1A),血氣分析(圖1B-C),尿液生化(圖1D-E)。
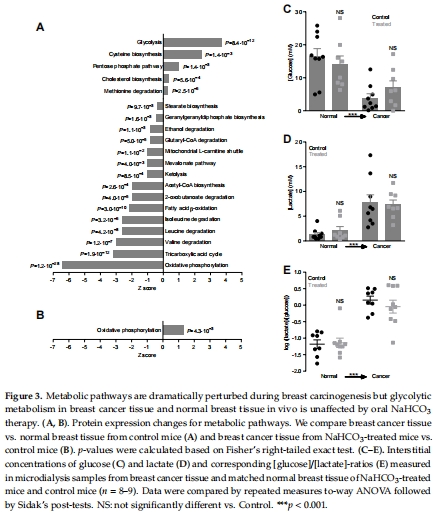
代謝:微透析監測腫瘤間隙葡萄糖/乳酸(圖3C-E),高通量蛋白質組學(圖1F-H, 圖3A-B)。
細胞功能:離體器官樣體測細胞內pH?(圖4)、凈酸排出能力(圖4D-E)、增殖(BrdU標記,圖6D-F)。
病理:腫瘤發生率、負荷、組織分型(圖2)。
4. 關鍵數據及其意義
(1)Unisense電極pH?數據(圖1A)
數據:治療組腫瘤pH?顯著升高(6.68±0.04 → 7.04±0.09)。
意義:首次證實口服NaHCO?可有效中和腫瘤酸性微環境,為后續機制研究提供基礎。
(2)代謝與蛋白組數據
微透析(圖3C-E):腫瘤間隙乳酸↑/葡萄糖↓(vs.正常組織),但治療未改變糖酵解速率([乳酸]/[葡萄糖]比無差異)。
蛋白質組(圖3A-B):腫瘤中糖酵解通路蛋白↑,氧化磷酸化↓;治療部分恢復氧化磷酸化(可能增強癌細胞能量供應)。
(3)細胞功能數據
凈酸排出(圖4D-E):治療組凈酸排出能力↑(尤其pH?>7.0時),且與腫瘤早發相關(圖4F)。
增殖(圖6E-F):治療組癌細胞增殖率↑(pH?=7.4時+37%,pH?=6.8時+52%),需HCO??存在。
(4)病理數據(圖2)
腫瘤發生率(85.5±8.2d vs. 82±7.5d)、負荷、組織分型均無組間差異,表明治療無凈抗腫瘤效應。
5. 丹麥Unisense電極數據的專項解讀
(1)技術創新性
原位高精度監測:OX-100玻璃電極(500μm尖端)穿透腫瘤組織,直接獲取活體pH?,避免離體測量失真。
動態控制:結合機械通氣維持血碳酸正常(圖1B),排除呼吸性酸中毒干擾。
(2)科學意義
1.量化治療有效性:證實NaHCO?可使腫瘤pH?↑0.35,但未達預期治療目標(pH?>7.4才可能顯著抑制轉移)。
2.揭示微環境復雜性:pH?升高伴隨癌細胞適應性增強(酸排出↑、增殖↑),解釋治療失效原因。
3.指導后續研究:提示需聯合酸轉運抑制劑(如靶向NBCn1/NHE1)阻斷癌細胞適應性。
6. 研究結論
1.矛盾效應:口服NaHCO?雖中和腫瘤酸性,但同時增強癌細胞適應性(酸排出↑、增殖↑),導致無凈抗腫瘤效果。
2.機制核心:微環境pH?升高解除對癌細胞的抑制,而非削弱其惡性表型。
3.臨床啟示:單一堿性治療可能無效,需聯合靶向酸轉運蛋白(如NBCn1)策略。
Unisense數據的跨領域價值
該技術不僅提供腫瘤微環境原位監測金標準,更推動癌癥治療新思路:
動態干預評估:實時監測pH?變化優化給藥方案。
微環境與細胞互作:揭示物理化學參數如何驅動癌細胞適應性進化。
轉化醫學:警示堿性療法需嚴格評估促癌風險。