熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Semi-quantitative detection of hydrogen-associated or -free electron transfer within methanogenic biofilm of microbial electrosynthesis
微生物電合成產甲烷生物膜內氫締合或無氫電子轉移的半定量檢測
來源:AEM Accepted Manuscript Posted Online 19 June 2020
摘要核心發現
本研究通過丹麥Unisense微電極實現了陰極生物膜內氫濃度的原位檢測,揭示:
1.氫梯度分布:
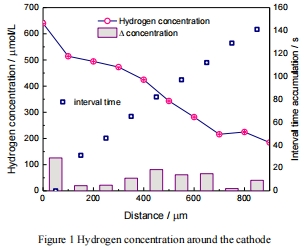
陰極表面氫濃度最高(639.91 μmol/L),隨距離增加而衰減,在生物膜區(100 μm內)銳減21%(圖1);
2.雙路徑電子轉移:
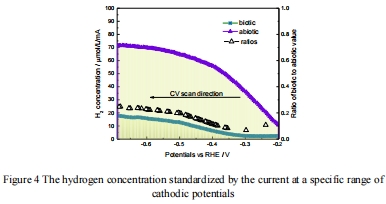
氫關聯路徑貢獻甲烷生成的電子轉移比例為21.20%±1.57%(電位-0.4~-0.69 V),非氫路徑為主導(圖4);
3.生物膜協同機制:
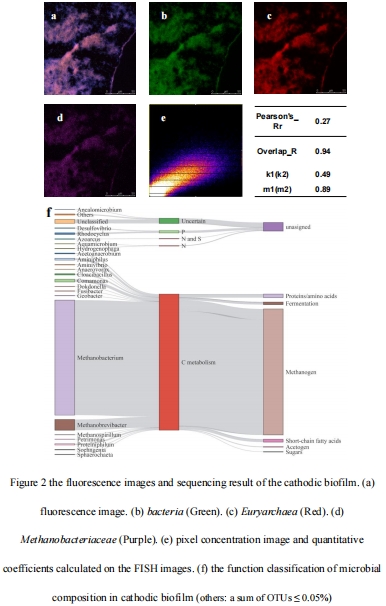
58.1 μm厚生物膜中細菌-古菌共定位(Pearson R=0.78),協同消耗氫(圖2)。
研究目的
1.解決爭議問題:
明確混合培養陰極生物膜中氫在電子轉移中的作用(直接 vs. 間接路徑);
2.開發檢測方法:
建立微電極-CV聯用技術(MS-CV),實現生物膜內氫動力學的半定量分析;
3.揭示產甲烷機制:
解析氫關聯路徑對微生物電合成系統(MES)甲烷生成的貢獻率。
研究思路
1. 反應器構建與生物膜培養
產甲烷MES反應器:
單室設計(150 mL),陰極碳布負載Pt/C催化劑,陽極碳刷預處理(丙酮浸泡+450℃灼燒);
生物膜培養:
接種廢水污泥+長期運行反應器出水,0.8 V恒壓運行至甲烷產量穩定(約30天)。
2. 多尺度檢測技術聯用
空間尺度:
Unisense氫微電極(H2-10型)掃描生物膜氫梯度(步進精度μm級);
時間尺度:
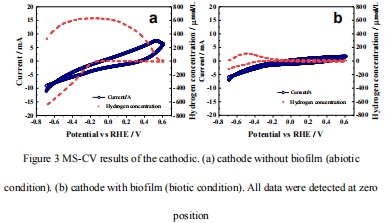
MS-CV技術(掃描速率2 mV/s)同步監測電位-電流-氫濃度動態(圖3);
生物結構解析:
FISH成像確定生物膜厚度(58.1 μm)及微生物空間分布(圖2)。
3. 電子轉移路徑量化
氫貢獻率計算:
標準化氫濃度(μmol/L/mA)對比生物/非生物條件(圖4),結合電子平衡方程:
氫關聯電子比例=1?非生物條件標準化[H2]/生物條件標準化[H2]
電位依賴驗證:
在-0.69 V、-0.54 V、-0.39 V下測定甲烷/氫產量,驗證熱力學可行性。
關鍵數據及研究意義
1. 氫空間梯度(圖1)
數據:
陰極表面[H?]=639.91 μmol/L → 100 μm處降至514.13 μmol/L(衰減率19.6%);
意義:
證實生物膜在微米尺度內快速消耗氫,為氫關聯電子轉移提供直接證據;
機制:
100 μm內衰減速率超擴散模型預測,表明微生物活性驅動氫消耗。
2. 生物膜群落結構(圖2)
數據:
FISH顯示古菌(紅色)與細菌(綠色)共定位(Pearson R=0.78),Methanobacteriaceae占比87.12%;
意義:
揭示氫營養型產甲烷菌主導氫消耗,發酵菌(6.43%)提供次級代謝支持;
機制:
多營養級協作(發酵-產甲烷菌模型)提升甲烷產率。
3. MS-CV動態響應(圖3)
數據:
生物條件下析氫起始電位負移(-0.30 V vs. 非生物-0.15 V),過電位增加;
意義:
生物膜抑制析氫反應,促進電子向非氫路徑分流;
機制:
微生物即時消耗氫降低局部[H?],推動反應平衡向析氫方向移動。
4. 氫貢獻率量化(圖4)
數據:
標準化[H?]:生物條件(2.42~17.97 μmol/L/mA) vs. 非生物(9.83~71.61 μmol/L/mA);
意義:
計算得出氫關聯電子轉移貢獻率21.20%±1.57%(電位-0.4~-0.69 V);
機制:
低電位區(<-0.4 V)氫關聯路徑激活,高電位區以直接電子轉移為主。
丹麥Unisense電極的核心貢獻
技術突破
原位微尺度監測:
10 μm尖端分辨率(文獻H2-10型)實現58.1 μm生物膜內氫梯度測繪(圖1);
動態過程解析:
2秒采樣間隔捕捉CV掃描中氫濃度瞬態變化(圖3),揭示電位依賴的析氫-消耗平衡;
生物/非生物對比:
標準化氫濃度量化微生物代謝對氫消耗的貢獻(圖4)。
關鍵發現
1.氫消耗熱點定位:
生物膜前100 μm消耗約20%氫,對應產甲烷菌富集區(圖1+圖2);
2.電子轉移路徑驗證:
氫關聯路徑貢獻率約21%,修正了“氫為唯一載體”的傳統認知;
3.代謝動力學參數:
析氫過電位增加150 mV,為生物電化學系統優化提供關鍵參數。
不可替代性
傳統方法局限:
氣相色譜僅提供體相[H?],無法解析生物膜微環境;
Unisense優勢:
微米級空間分辨率與秒級時間分辨率聯用,首次揭示生物膜內氫周轉動力學。
結論
1.雙路徑電子轉移:
混合培養陰極生物膜中,氫關聯路徑貢獻約21%電子轉移,非氫路徑(可能為直接電子轉移)占主導;
2.電位調控策略:
-0.4 V以下電位激活氫關聯路徑,優化電位可提升甲烷電子效率至0.69 mol CH?/mol e?(0.6 V時);
3.生物膜工程啟示:
強化古菌-細菌共定位可提升氫周轉速率,降低系統過電位。
Unisense技術價值:其原位微尺度氫監測能力為生物電化學系統提供了不可替代的機制研究工具,推動從“黑箱模型”向“過程解析”的范式轉變。
圖示關聯:
圖1:Unisense微電極測量的氫空間梯度
圖2:FISH成像的生物膜結構(古菌-細菌共定位)
圖3:MS-CV聯用的氫動態響應
圖4:標準化氫濃度與電子轉移貢獻率計算