熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Oxygen therapy alleviates hepatic steatosis by inhibiting hypoxia-inducible factor-2α
2α 氧療通過抑制缺氧誘導因子-2α 緩解肝脂肪變性
來源:Journal of Endocrinology (2020) 246, 57–67
1. 摘要核心內容
本研究首次證實氧療(OT)通過抑制缺氧誘導因子HIF-2α改善非酒精性脂肪肝(NAFLD)。核心發現:
動物模型:高脂飲食(HFD)小鼠經OT(88% O?,1小時/次,每日2次)干預8周后:
肝靜脈血氧濃度↑(圖1A);
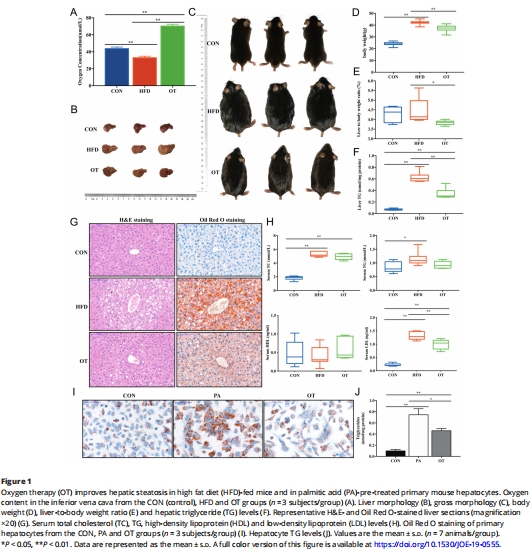
肝臟脂肪變性減輕(甘油三酯↓,脂滴減少,圖1F-G);
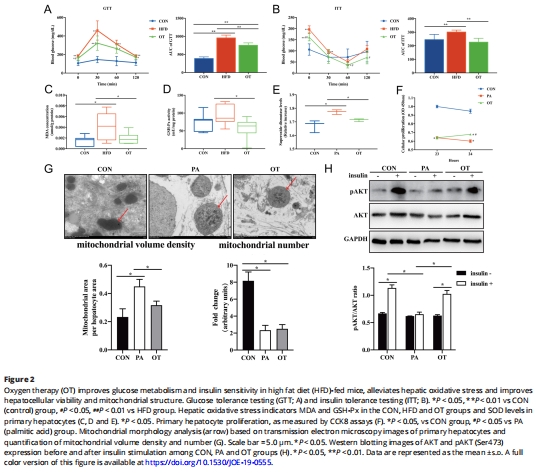
胰島素敏感性↑(圖2A-B)。
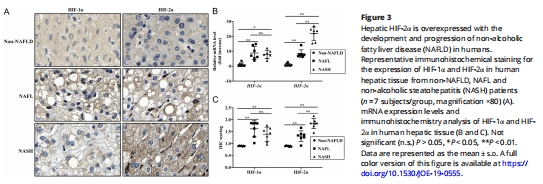
臨床關聯:NAFLD患者肝組織中HIF-2α表達與疾病進展正相關(圖3A-C);
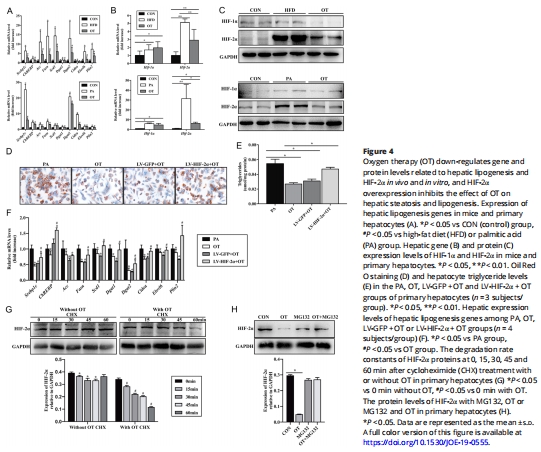
機制驗證:OT通過抑制HIF-2α合成并促進其泛素化降解,下調脂生成基因(Srebp1c、Fasn等,圖4A,F),而HIF-2α過表達逆轉OT療效(圖4D-F)。
2. 研究目的
1.驗證OT對NAFLD的療效及安全性;
2.闡明HIF-2α在OT改善脂肪肝中的作用機制;
3.探索OT臨床轉化潛力。
3. 研究思路
臨床觀察→動物驗證→細胞機制:
1.臨床樣本:分析NAFL/NASH患者肝組織HIF-2α表達(圖3);
2.動物模型:HFD小鼠OT干預,檢測血氧、肝脂代謝、糖耐量(圖1-2);
3.細胞機制:棕櫚酸(PA)誘導肝細胞脂肪變性,OT干預并過表達HIF-2α驗證靶點(圖4)。
4. 關鍵數據及研究意義
(1)OT改善肝脂肪變性(圖1)
數據:
血氧濃度:OT使肝靜脈血氧↑(Unisense電極測量,圖1A);
肝脂含量:甘油三酯↓50%,脂滴減少(H&E/Oil Red O染色,圖1F-G);
體重/肝重比:↓15%(圖1C-E)。
意義:首次證實OT可有效逆轉NAFLD核心病理特征。
(2)OT改善胰島素敏感性(圖2)
數據:
糖耐量(GTT):血糖曲線下面積↓30%(圖2A);
胰島素耐量(ITT):胰島素敏感性↑25%(圖2B);
胰島素信號通路:Akt磷酸化↑(Western blot)。
意義:揭示OT對NAFLD伴隨代謝紊亂的協同改善作用。
(3)HIF-2α驅動NAFLD進展(圖3-4)
數據:
臨床樣本:NASH患者HIF-2α表達較非NAFLD組↑3倍(圖3A-C);
機制驗證:OT使HIF-2α蛋白半衰期↓50%(泛素化降解↑,圖4G-H);
功能回復:HIF-2α過表達使OT抑脂效果喪失(圖4D-F)。
意義:確立HIF-2α為OT治療NAFLD的核心靶點。
5. 核心結論
1.OT安全有效:88%濃度OT顯著改善HFD小鼠脂肪肝及胰島素抵抗;
2.HIF-2α核心作用:OT通過抑制HIF-2α表達及穩定性,下調脂生成基因(Srebp1c/Fasn等);
3.臨床轉化潛力:NAFLD患者肝HIF-2α表達與疾病嚴重度正相關,支持OT臨床推廣。
6. 丹麥Unisense電極的研究意義
技術原理與數據:
功能:采用Unisense針式氧微電極(OX-NP,1.6×40 mm)實時監測肝靜脈血氧分壓:
動態監測:麻醉小鼠肝靜脈穿刺,直接讀取血氧濃度(圖1A);
關鍵結果:OT組血氧濃度較HFD組↑2倍(*P<0.01)。
技術優勢:
微創精準:針式傳感器穿透血管壁直接獲取血氧數據,規避組織氧擴散干擾;
高時空分辨率:秒級響應捕捉OT后肝微循環氧合動態變化。
科學價值:
1.直接驗證缺氧假說:
首次提供原位證據證實NAFLD肝缺氧(HFD組血氧↓),打破間接推論的局限;
為"OT改善肝缺氧"提供直接量化支持(圖1A數據聯動圖1F-G肝脂變改善)。
2.指導治療參數優化:
證實88%氧濃度(1 atm)為安全有效閾值(避免高氧炎癥風險);
揭示OT 1小時即可顯著提升肝氧供,指導臨床方案設計。
領域貢獻:
確立Unisense電極為肝微循環缺氧研究金標準,尤其適用于代謝性疾病模型;
為NAFLD治療提供新型療效評估工具(血氧濃度可作為治療響應標志物)。
機制圖示:
肝缺氧 → HIF-2α↑ → 脂生成基因激活 → 脂肪堆積
↑ │
│ OT干預 ↓
└───────血氧濃度↑(Unisense驗證)
臨床啟示:
診斷應用:Unisense電極可拓展至NAFLD患者肝血氧無創監測;
治療監測:肝靜脈血氧濃度或成OT療效動態評估指標。