熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
FANCD2 modulates the mitochondrial stress response to prevent common fragile site instability
FANCD2 調節線粒體應激反應以防止常見的脆弱部位不穩定
來源:COMMUNICATIONS BIOLOGY | (2021) 4:127
一、摘要概述
本研究揭示了FANCD2蛋白通過調控線粒體應激反應(mtUPR)維持常見脆性位點(CFSs)基因組穩定性的新機制。核心發現包括:
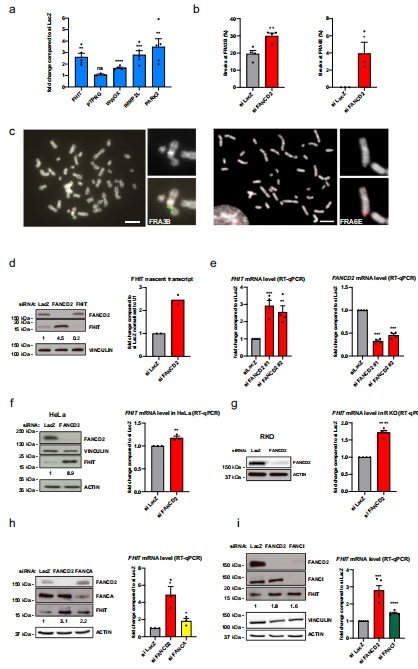
FANCD2缺失誘導CFS基因(如FHIT、PARK2)轉錄上調,導致染色體斷裂增加(圖1a-c)。

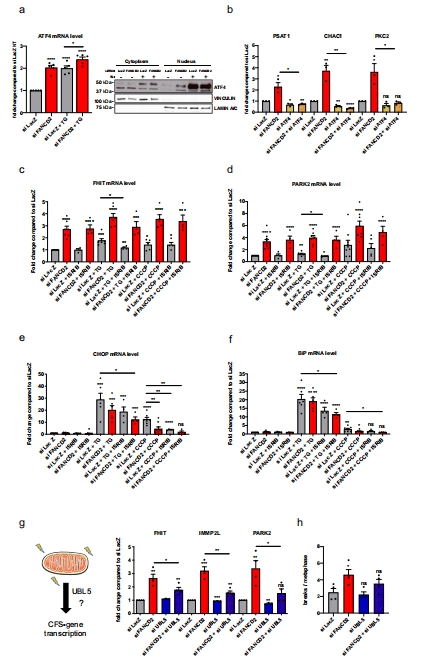
線粒體功能障礙是CFS不穩定的誘因:FANCD2缺失導致OXPHOS異常(ATP合成↓、耗氧量↑),激活mtUPR(圖4a)。

UBL5介導的mtUPR信號驅動CFS基因表達,FANCD2通過抑制UBL5通路維持基因組穩定(圖6g-h)。

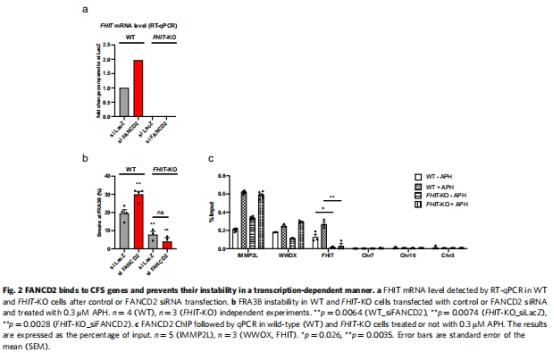
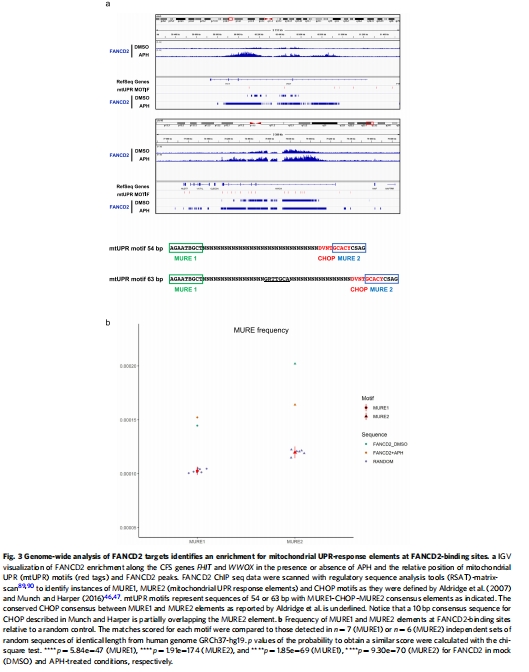
FANCD2直接結合CFS基因的線粒體應激響應元件(MURE),其結合依賴轉錄活性(圖2c, 圖3b)。
二、研究目的
解析CFS不穩定機制:探究FANCD2缺失如何通過線粒體應激誘導CFS斷裂。
明確FANCD2的非經典功能:揭示其在mtUPR信號通路中的調控作用。
建立代謝-基因組穩定性關聯:驗證線粒體功能失調與染色體脆性的因果關系。
三、研究思路
采用 “表型→機制→通路驗證” 策略:
表型觀察:
FANCD2缺失導致CFS基因表達↑和染色體斷裂↑(圖1a-c)。
線粒體抑制劑(NaN?)或低氧(3% O?)可逆轉CFS表達(圖4b-c)。
機制探索:
ChIP-seq顯示FANCD2富集于含MURE元件的CFS基因(圖3a-b)。
線粒體應激誘導劑(CCCP/TG)促進FANCD2在CFS位點聚集(圖5d)。


通路驗證:
UBL5敲除抑制FANCD2缺失誘導的CFS表達及斷裂(圖6g-h)。
ATF4(mtUPR轉錄因子)部分參與CFS調控(圖6b)。
四、關鍵數據及研究意義
1. CFS基因表達與斷裂(圖1, 圖4)
數據來源:RT-qPCR檢測基因表達(圖1a, 4b-c);FISH分析染色體斷裂(圖1b, 4d-e)。
結果:
FANCD2缺失使FHIT表達↑2.5倍,斷裂率↑3倍(圖1a-b)。
低氧(3% O?)或NaN?處理抑制CFS表達(圖4b-c)。
意義:CFS穩定性受線粒體代謝狀態直接調控。
2. 線粒體功能指標(圖4a)
數據來源:
丹麥Unisense電極測量細胞耗氧量(方法部分)。
酶聯法檢測ATP合成、復合體I-III活性等。
結果:
FANCD2缺失細胞耗氧量↑30%,ATP合成↓40%(圖4a)。
復合體I-III電子傳遞效率↓50%。
意義:揭示FANCD2維持OXPHOS功能,其缺失導致能量代謝紊亂。
3. FANCD2基因組定位(圖3, 圖5)
數據來源:ChIP-seq和ChIP-qPCR(圖3a-b, 5d)。
結果:
FANCD2結合位點富集MURE1/2元件(圖3b)。
CCCP處理使FANCD2在FHIT位點富集↑4倍(圖5d)。
意義:FANCD2作為mtUPR感應器,直接調控CFS基因轉錄。
4. UBL5通路驗證(圖6g-h)
數據來源:雙敲除實驗(RT-qPCR + FISH)。
結果:UBL5敲除使FANCD2缺失細胞的CFS斷裂率↓60%(圖6h)。
意義:UBL5是mtUPR調控CFS的關鍵介質,FANCD2通過抑制其活性維持穩定。
五、結論
FANCD2是線粒體-細胞核通訊樞紐:通過抑制UBL5-mtUPR通路,防止CFS基因過度轉錄(圖7a)。
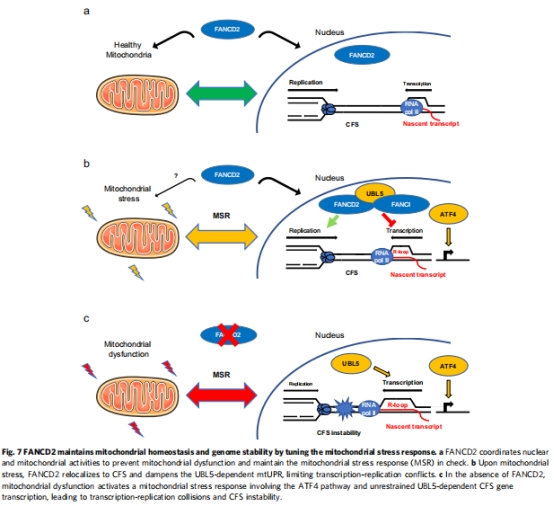
代謝應激驅動基因組不穩定:線粒體功能障礙→mtUPR激活→CFS表達↑→復制-轉錄沖突→染色體斷裂。
理論創新:首次建立FANCD2-UBL5軸協調代謝與基因組穩定的模型(圖7c)。
六、丹麥Unisense電極數據的詳細解讀
1. 技術原理與實驗設計
原理:
Unisense微電極采用安培法,通過Clark傳感器實時檢測單細胞耗氧量(μM級分辨率)。
校準:空氣飽和(高氧)vs. 氮氣飽和(零氧)緩沖液。
實驗設計:
測量FANCD2缺失細胞的氧消耗速率(OCR)。
比較對照組與處理組(如NaN?抑制)的OXPHOS效率(方法部分)。
2. 關鍵結果(圖4a)
數據定位:圖4a(右面板“Oxygen consumption”)。
結果:
FANCD2缺失細胞基礎OCR↑30%(***p=0.0004)。
ATP合成效率↓40%(**p=0.0017),提示OXPHOS解偶聯。
意義:
揭示代謝缺陷:FANCD2缺失導致線粒體呼吸鏈“漏電”,能量轉化效率降低。
連接表型與機制:OCR異常先于CFS斷裂出現,表明線粒體功能障礙是基因組不穩定的上游誘因。
3. 研究價值
技術優勢:毫秒級分辨率捕捉動態氧耗,為代謝-基因組關聯研究提供直接證據。
生物學啟示:
證明OXPHOS效率是CFS穩定的生物標志物。
為FA(Fanconi貧血)患者線粒體靶向治療提供依據(如抗氧化劑改善造血缺陷)。
七、研究意義
理論突破:
顛覆“FANC通路僅修復DNA損傷”的傳統認知,揭示其調控代謝應激的新功能。
提出“CFS是細胞代謝檢查點”假說(圖7b)。
臨床價值:
解釋FA患者癌癥易感性:線粒體失調→CFS斷裂→基因組重排。
為靶向mtUPR(如UBL5抑制劑)治療染色體不穩定疾病提供新策略。
技術貢獻:
整合ChIP-seq、Unisense電極等多維技術,建立代謝-基因組整合分析范式。