熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
標題:The transcriptional regulator RbcR controls ribulose-1,5-bisphosphate carboxylase/oxygenase (RuBisCO) genes in the cyanobacterium Synechocystis sp. PCC 6803
轉錄調節因子 RbcR 控制藍藻集胞藻屬 (Synechocystis sp) 中的核酮糖 1,5-二磷酸羧化酶加氧酶 (RuBisCO) 基因
來源:New Phytologist (2022) 235: 432–445, doi:10.1111/nph.18139
摘要核心內容
本研究首次證實藍藻(Synechocystis sp. PCC 6803)中轉錄調控因子 RbcR(由基因 sll0998 編碼)通過結合 rbcLXS 啟動子調控 RuBisCO 基因表達,并定義其調控網絡。關鍵發現包括:
1.RbcR 的必需性:敲除 rbcR 導致藍藻無法存活,表明其對細胞生存至關重要。
2.調控機制:RbcR 作為 LysR 型轉錄激活因子,結合靶基因啟動子中的保守基序 ATTA(G/A)-N5-(C/T)TAAT,激活 rbcLXS(RuBisCO 編碼基因)、sbtA(碳酸氫鹽轉運蛋白)和 ccmKL(羧酶體組分)等碳同化相關基因(表1)。
3.協同調控網絡:RbcR 與已知碳調控因子 NdhR 和 CmpR 共同構成藍藻碳同化三級調控系統,其中 RbcR 直接響應碳限制條件,增強碳濃縮機制(CCM)。
4.應用潛力:闡明 RbcR 調控機制為工程化藍藻細胞工廠(如 CO? 固定和化學品生產)提供新靶點。
研究目的
1.驗證 RbcR 功能:明確 sll0998 基因產物是否調控 RuBisCO 及碳同化相關基因。
2.解析 DNA 結合特性:鑒定 RbcR 的 DNA 結合基序及其靶基因。
3.闡明調控網絡:揭示 RbcR 在藍藻碳同化中的協同調控作用。
4.探索工程應用:為藍藻碳固定效率優化提供理論依據。
研究思路
采用 遺傳學-分子生物學-生理學 多維度策略:
1.遺傳操作:
1.構建條件性 rbcR 敲低株(P0998)和過表達株(0998+),以野生型(WT)和啟動子插入對照株(C0998)為基準。
2.通過不完全分離突變體(P0998 保留 WT 等位基因)規避致死表型。
2.表達分析:
1.微陣列芯片篩選差異表達基因,Northern/Western blot 驗證 rbcL 轉錄及蛋白水平變化。
3.DNA 互作驗證:
1.EMSA 實驗證實 RbcR 蛋白特異性結合 rbcL、sbtA、ccmK 啟動子。
2.基序突變實驗驗證保守序列 ATTA(G/A)-N5-(C/T)TAAT 對結合的關鍵作用。
4.生理表型檢測:
1.測量光合放氧速率(丹麥 Unisense 微電極系統)、生長曲線及色素含量。
5.調控網絡整合:
1.結合已有 NdhR/CmpR 調控數據,構建碳同化三級調控模型。
測量數據及其研究意義
研究通過多組學數據揭示 RbcR 功能,關鍵數據來源及意義如下:
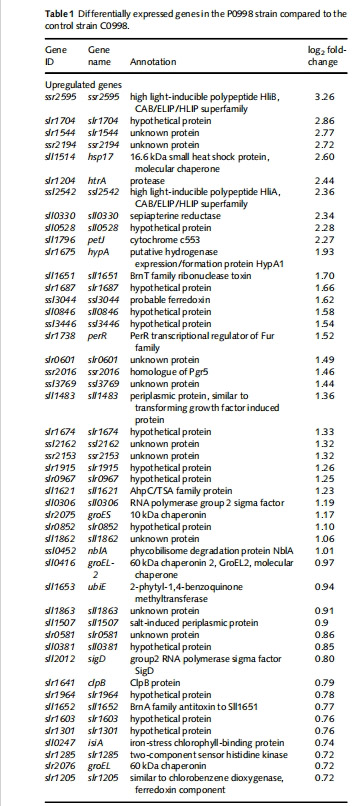
1. 基因表達譜(表1,圖2)
數據來源:微陣列芯片分析 P0998 vs C0998。
核心發現:
orbcLXS(RuBisCO 基因)下調 4.6 倍(log? FC = -0.93)。
osbtA(HCO?? 轉運蛋白)下調 8 倍(log? FC = -2.99)。
occmK(羧酶體蛋白)下調 1.7 倍(log? FC = -0.75)。
意義:首次證實 RbcR 正調控 RuBisCO 及 CCM 關鍵基因,填補藍藻碳同化轉錄調控空白。
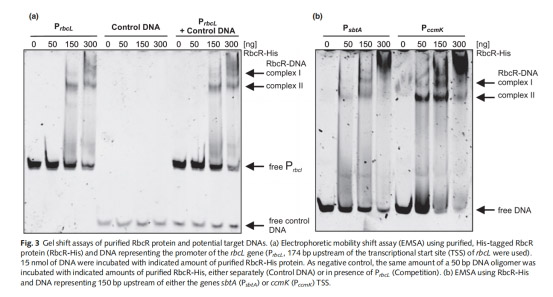
2. 蛋白-DNA 互作(圖3)
數據來源:EMSA 實驗(凝膠遷移阻滯分析)。
核心發現:
oRbcR-His 蛋白結合 rbcL 啟動子(PrbcL),形成特異性復合物(圖3a)。
o突變保守基序(ATTA→GGGG)顯著降低結合親和力(圖4c)。
意義:揭示 RbcR 通過直接結合 DNA 基序調控靶基因,確立其轉錄激活因子身份。
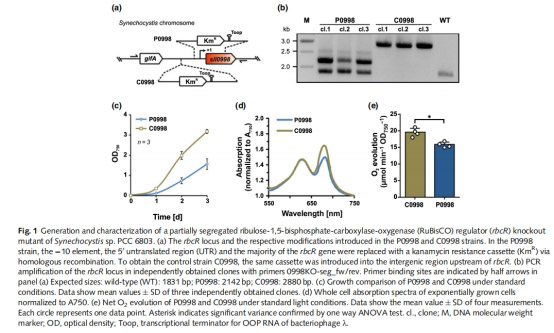
3. 生理表型(圖1c-e)
數據來源:生長曲線、全細胞吸收光譜、光合放氧速率。
核心發現:
oP0998 生長減緩(圖1c)、葉綠素 a 含量降低(A680 nm↓,圖1d)。
o光合放氧速率下降(圖1e)。
意義:RbcR 缺失導致碳同化能力受損,印證其核心生理功能。
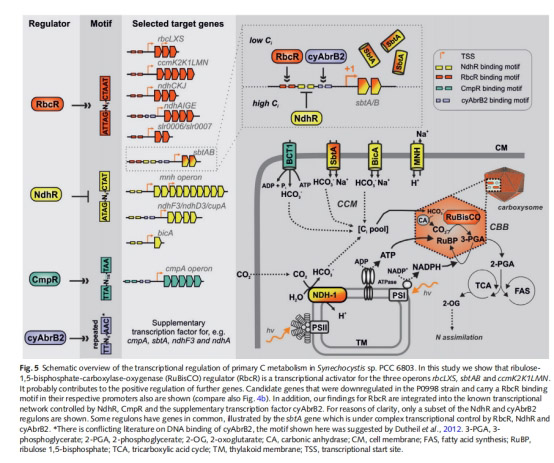
4. 調控網絡整合(圖5)
數據來源:啟動子基序掃描與已知調控因子互作分析。
核心發現:
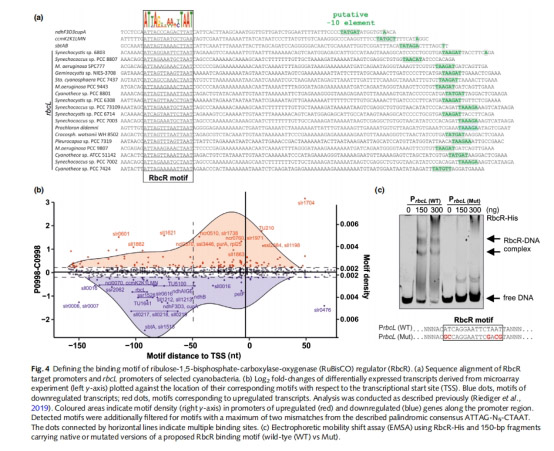
oRbcR 靶基因啟動子含保守基序(圖4a),位置決定激活/抑制功能(-90 bp 激活,-10 bp 抑制)。
oRbcR 與 NdhR、CmpR 協同調控碳同化基因(如 sbtA 受三者共同調控)。
意義:構建藍藻碳調控三級模型,為理性設計高固碳菌株提供靶點。
丹麥 Unisense 微電極測量數據的詳細解讀
研究使用 Unisense O?-MR 微呼吸系統(型號:O?微傳感器)測量藍藻光合放氧速率,核心研究意義如下:
1. 技術原理
基于 Clark 型微電極,通過電化學檢測溶解氧濃度變化,空間分辨率達微米級。
實驗設計:
o藍藻細胞(OD??? = 0.5)經 N? 沖洗后,添加 5 mM NaHCO?。
o在 50 μmol photons·m?2·s?1 光強下監測 5 分鐘放氧,隨后關燈監測 2 分鐘耗氧(計算凈放氧速率)。
2. 關鍵發現(圖1e)
RbcR 缺失株(P0998)光合受損:
o凈放氧速率顯著低于對照株(C0998)。
o意義:直接證明 RbcR 通過調控 RuBisCO 和 CCM 基因,影響藍藻光合碳同化效率。
關聯碳同化機制:
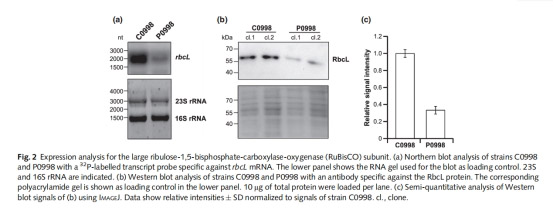
o放氧速率下降與 rbcL 表達降低(圖2)、RuBisCO 蛋白減少(圖2c)一致,證實 RbcR 是碳同化限速步驟的轉錄調控樞紐。
3. 技術優勢
原位動態監測:克服傳統端點法局限,實時捕捉光合響應。
高靈敏度:精準量化低生物量樣本的代謝活性,適用于突變體表型分析。
結論
1.RbcR 是藍藻碳同化的核心轉錄激活因子:
o通過結合保守基序 ATTA(G/A)-N5-(C/T)TAAT,直接激活 rbcLXS、sbtA、ccmK 等基因表達。
2.三級調控網絡:
oRbcR 與 NdhR(抑制 CCM 基因)、CmpR(激活 cmp 操縱子)協同響應碳限制,優化碳同化效率(圖5)。
3.工程應用價值:
o靶向 RbcR 或其調控網絡可增強藍藻固碳能力,支持碳中和及光驅生物制造。
關鍵圖表索引:
圖1:rbcR 突變株構建與表型(生長、色素、放氧速率)
圖2:rbcL 轉錄及蛋白表達驗證(Northern/Western blot)
圖3:RbcR 蛋白與靶啟動子 DNA 結合(EMSA)
圖4:RbcR 結合基序鑒定與功能驗證
圖5:藍藻碳同化三級調控網絡模型