熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
標題:Effects of Epiphytic Biofilm Activity on the Photosynthetic Activity, pH and Inorganic Carbon Microenvironment of Seagrass Leaves (Zostera marina L.)
附生生物膜活性對海草葉光合活性、pH 值和無機碳微環境 (Zostera marina L.) 的影響
來源:期刊 Frontiers in Marine Science,發表日期 2022年5月10日
摘要核心內容
本研究通過微傳感器技術,探究了附生生物膜對海草(Zostera marina)葉片光合作用、pH和無機碳微環境的影響。關鍵發現包括:
1. 生物膜活性主導氧氣產生:在光照下,活性生物膜(含微生物群落)的葉片O?通量是惰性生物膜(人工無菌瓊脂層)的3.2倍,表明生物膜光合作用貢獻了葉片微環境中大部分O?。
2. 生物膜誘導強堿化:活性生物膜使葉面pH升至8.9(光照下),遠高于惰性生物膜(pH 8.2)和裸露葉片(pH 7.9),加劇CO?限制。
3. 無機碳利用轉變:活性生物膜下,葉面CO?濃度降至0.1 μmol L?1(惰性膜下為9.7 μmol L?1),迫使海草依賴HCO??(占碳通量97%)進行光合作用,增加能量消耗。
4. 擴散屏障與生物活性協同作用:生物膜厚度增加擴散距離(TDD=710 μm),但其微生物活動是驅動微環境變化(高O?、高pH、低CO?)的主因。
研究目的
1. 區分生物膜作用機制:量化附生生物膜的微生物活性(如光合/呼吸)與物理擴散屏障效應對海草葉片微環境的獨立貢獻。
2. 闡明碳限制機制:揭示生物膜如何通過改變pH和無機碳形態(CO? vs. HCO??)影響海草光合效率。
3. 評估生態影響:為富營養化海域中海草衰退(因生物膜過度生長)提供機制解釋。
研究思路
1. 實驗設計:
活性生物膜:天然附生生物膜覆蓋的海草葉片。
惰性生物膜:用無菌瓊脂層模擬生物膜厚度(無微生物活性),僅保留擴散屏障效應。
對照組:裸露葉片(無生物膜)、生物膜移除后的葉片。
2. 微環境監測:
使用丹麥Unisense微電極(O?和pH傳感器)原位測量葉片表面O?濃度、pH梯度及擴散邊界層(DBL)。
結合總無機碳(DIC)數據,計算CO?和HCO??濃度與通量。
3. 條件對比:
光照(230 μmol photons m?2 s?1) vs. 黑暗。
測量位置:生物膜-水界面、葉片-生物膜界面。
4. 數據分析:
通量計算(Fick擴散定律)、統計檢驗(t檢驗)比較不同處理間的O?/碳通量差異。
測量數據及其研究意義
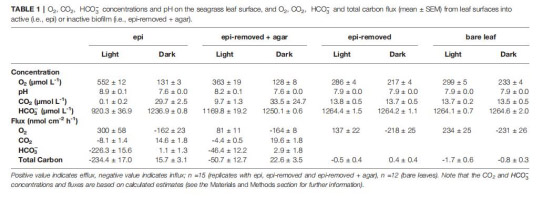
1. O?濃度與通量(圖2、圖6A;表1)
數據:
光照下,活性生物膜葉面O?濃度達552 μmol L?1(惰性膜:363 μmol L?1)。
O?通量:活性膜(300 nmol cm?2 h?1) > 惰性膜(81 nmol cm?2 h?1)。
意義:生物膜微生物光合作用是O?主要來源(貢獻69%),其活性加劇葉片超氧環境,可能促進光呼吸。
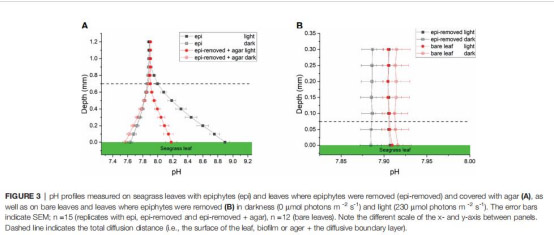
2. pH梯度(圖3;表1)
數據:活性生物膜使葉面pH升至8.9(惰性膜:8.2),黑暗時降至7.6。
意義:生物膜光合作用消耗CO?導致強堿化,推動碳酸平衡向HCO??移動,限制CO?可用性。
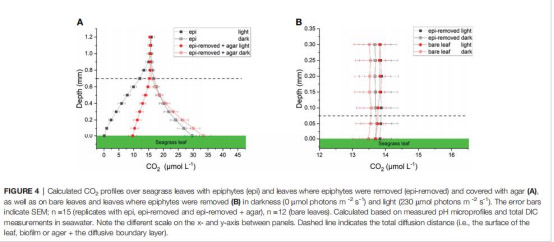
3. 無機碳形態與通量(圖4、5、6B-D;表1)
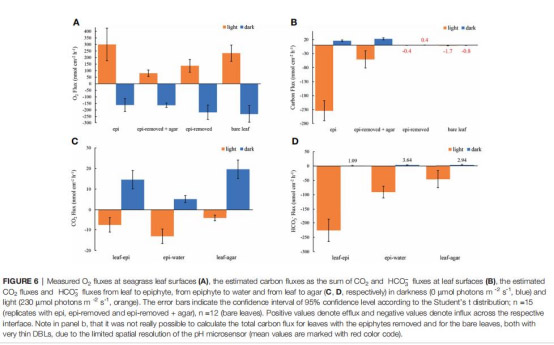
數據:
活性膜葉面CO?濃度僅0.1 μmol L?1(惰性膜:9.7 μmol L?1)。
HCO??通量占比:活性膜(97%) > 惰性膜(91%)。
總碳通量:活性膜(234 nmol cm?2 h?1) > 惰性膜(51 nmol cm?2 h?1)。
意義:生物膜活動迫使海草依賴HCO??(高能耗過程),降低光合效率;CO?限制(葉面濃度<1 μmol L?1)是光合作用主要瓶頸。
4. 擴散距離(TDD)(圖2-5)
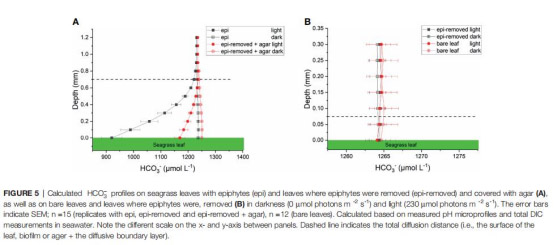
數據:生物膜增加TDD至710 μm(裸露葉片:90 μm)。
意義:物理屏障延緩氣體交換,但生物活性(非僅厚度)是驅動微環境變化的主因。
Unisense微電極數據的詳細解讀
技術原理與應用
傳感器類型:
O?微電極(OX-25):Clark型,尖端25 μm,響應時間<1秒,空間分辨率達微米級。
pH微電極(pH-100):尖端100 μm,敏感玻璃長度150-250 μm,需結合參比電極(REF-RM)。
校準:
O?電極:線性校準(空氣飽和海水 vs. 無氧溶液)。
pH電極:多點校準(pH 4/7/10緩沖液)。
測量流程:
1. 微電極固定于電動微操縱器,精確定位至葉片表面。
2. 步進式(2 μm步長)垂直剖面測量,穩態下記錄O?/pH梯度(光照/黑暗各>30分鐘平衡)。
研究意義
1. 高分辨率原位監測:
直接捕捉生物膜-葉片界面的O?/pH動態(如光照下O?躍升至552 μmol L?1),克服傳統破壞性采樣局限。
2. 量化微生物活性貢獻:
對比活性/惰性生物膜,明確微生物光合作用主導O?產生(圖6A)和堿化(圖3)。
3. 揭示碳限制機制:
pH微剖面數據計算CO?/HCO??濃度(圖4、5),證實活性生物膜使葉面CO?近乎耗盡(0.1 μmol L?1),解釋海草為何依賴高能耗的HCO??利用。
4. 支撐生態模型:
提供關鍵參數(如CO?通量僅占O?通量3%),優化海草光合-碳限制模型。
結論
1. 生物膜活性是微環境變化主因:微生物光合作用(非僅物理屏障)導致葉面超氧(O?↑)、強堿化(pH↑)和CO?枯竭(CO?↓),迫使海草依賴HCO??進行光合作用,增加能量消耗。
2. 雙重負面效應:
短期:CO?限制與高光呼吸降低光合效率。
長期:富營養化海域中生物膜過度生長威脅海草健康,加劇生態系統衰退。
3. 管理啟示:控制富營養化以減少生物膜過度增殖,是保護海草床的關鍵策略。
核心貢獻:首次量化生物膜微生物活性與物理屏障對海草微環境的獨立影響,為海草衰退機制提供高分辨率實證。