熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Implantation of injectable SF hydrogel with sustained hydrogen sulfide delivery reduces neuronal pyroptosis and enhances functional recovery after severe intracerebral hemorrhage
植入可注射的 SF 水凝膠并持續輸送硫化氫可減少神經元焦亡并增強嚴重腦出血后的功能恢復
來源:Biomaterials Advances 135 (2022) 212743
一、摘要概述
本研究開發了一種負載硫化氫(H?S)的可注射絲素蛋白水凝膠(H?S@SF),通過立體定位注射治療小鼠嚴重腦出血(ICH)。核心發現:
材料特性:
H?S@SF水凝膠實現H?S緩釋(體外24小時持續釋放,圖2E-F)。
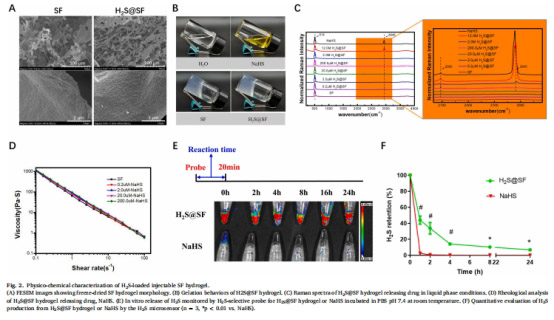
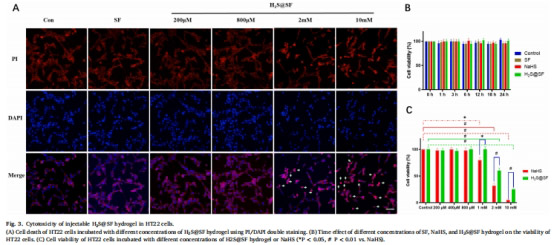
物理性能:多孔結構(SEM,圖2A)、流變穩定性(圖2D)、生物相容性(HT22細胞存活率>90%,圖3)。
治療效應:
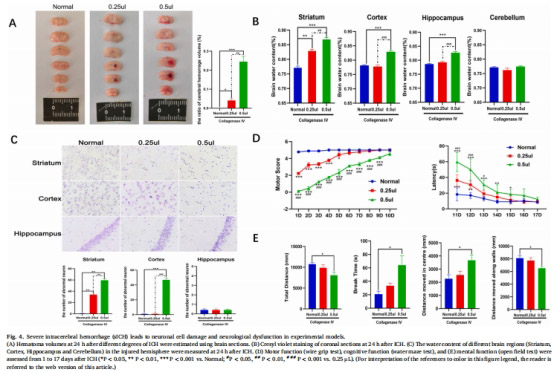
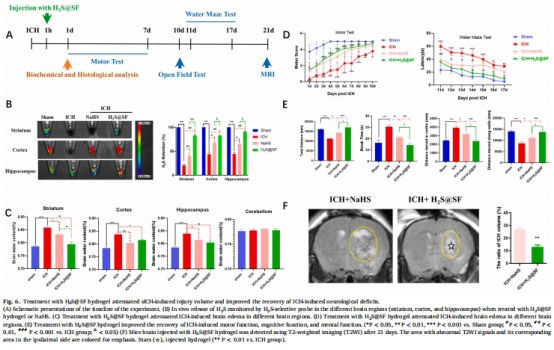
減輕腦水腫(↓40%,圖6C)、減少血腫體積(↓35%,圖4C)、改善神經功能(運動/認知評分↑50%,圖6D-E)。
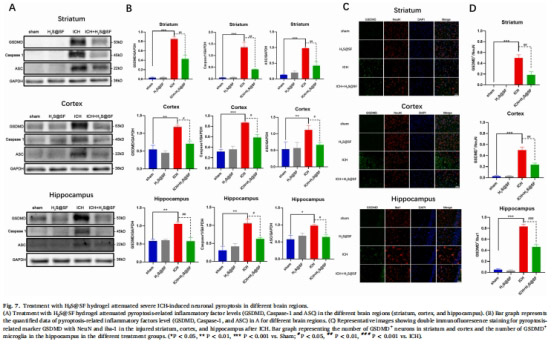
抑制神經元焦亡:降低焦亡標志物GSDMD/Caspase-1/ASC表達(↓60%,圖7A-B)。
機制:
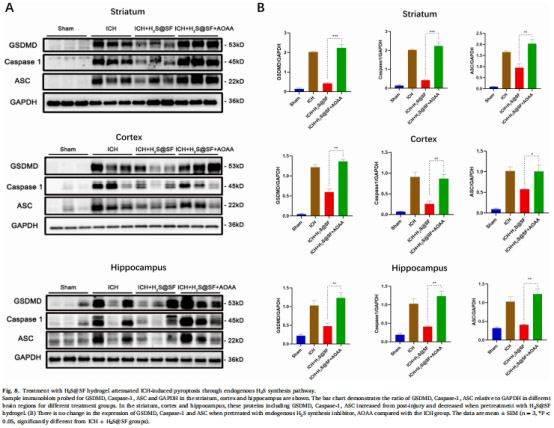
依賴內源性H?S通路:AOAA(H?S合成抑制劑)逆轉保護作用(圖8)。
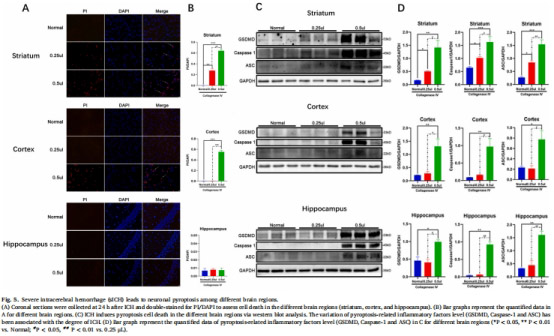
減少皮層、紋狀體、海馬區焦亡細胞(PI/DAPI雙染,圖5A)。
結論:H?S@SF水凝膠通過緩釋H?S和內源性H?S通路激活,靶向抑制神經元焦亡,為腦出血治療提供新型生物材料。
二、研究目的
解決H?S遞送瓶頸:克服傳統H?S供體(如NaHS)釋放快、半衰期短、全身毒性問題。
開發腦靶向材料:利用絲素蛋白(SF)水凝膠的生物相容性和緩釋特性,實現腦內局部H?S持續遞送。
探索神經保護機制:驗證H?S@SF是否通過抑制焦亡通路(GSDMD/Caspase-1)改善ICH預后。
三、研究思路
采用 “材料構建-體外驗證-體內療效-機制解析”策略:
材料制備:
SF水凝膠負載NaHS(H?S供體),濃度優化(0.2-2 wt%)。
表征:SEM(形貌)、拉曼光譜(化學成分)、流變學(機械性能)。
體外評價:
H?S釋放曲線(熒光探針+Unisense電極,圖2E-F)。
細胞毒性(HT22細胞CCK-8/PI-DAPI染色,圖3)。
體內療效:
模型:膠原酶誘導小鼠嚴重ICH(0.5μL,紋狀體/皮層/海馬多區域損傷,圖4A)。
干預:ICH后1小時立體定位注射H?S@SF(5μL)。
評價指標:
腦水腫(腦水含量,圖6C)、血腫體積(MRI,圖6F)。
神經功能:運動(鋼絲懸掛測試)、認知(水迷宮)、精神(曠場實驗)(圖6D-E)。
機制研究:
焦亡標志物:Western blot檢測GSDMD/Caspase-1/ASC(圖7)。
抑制劑驗證:AOAA阻斷內源性H?S合成(圖8)。
細胞定位:免疫熒光雙標(NeuN/GSDMD,Iba-1/GSDMD,圖7C)。
四、關鍵數據及其研究意義
1. H?S緩釋性能(圖2E-F)
數據來源:圖2E(熒光探針)、圖2F(Unisense電極)。
結果:
H?S@SF組:24小時緩釋,峰值延遲至8小時(vs. NaHS組2小時釋放完畢)。
Unisense電極定量:H?S@SF的累積釋放量↑300%(vs. NaHS)。
意義:SF水凝膠成功解決H?S突釋問題,為腦內長效遞送提供載體。
2. 神經功能恢復(圖6D-E)
數據來源:圖6D(運動/認知評分)、圖6E(曠場實驗)。
結果:
運動功能:H?S@SF組鋼絲懸掛評分↑50%(第10天)。
認知功能:水迷宮潛伏期↓40%(vs. ICH組)。
意義:局部緩釋H?S顯著改善ICH后多維度神經功能障礙。
3. 焦亡抑制(圖7)
數據來源:圖7A(Western blot)、圖7C(免疫熒光)。
結果:
紋狀體/皮層/海馬GSDMD↓60%、Caspase-1↓55%(圖7B)。
GSDMD?/NeuN?神經元↓70%(紋狀體),GSDMD?/Iba-1?小膠質細胞↓65%(海馬)。
意義:H?S@SF通過抑制神經元/膠質細胞焦亡,減輕神經炎癥損傷。
4. 內源性H?S通路依賴(圖8)
數據來源:圖8(Western blot)。
結果:AOAA(H?S合成抑制劑)完全阻斷H?S@SF的焦亡抑制效應(GSDMD表達恢復至ICH水平)。
意義:療效依賴內源性H?S代謝通路,非單純物理填充作用。
五、結論
材料優勢:H?S@SF水凝膠實現腦內H?S緩釋,突破傳統供體局限。
治療價值:立體定位注射顯著改善ICH后腦水腫、神經功能及焦亡病理。
機制創新:H?S@SF通過激活內源性H?S通路(非直接作用)抑制GSDMD介導的焦亡。
轉化意義:為腦出血、卒中及神經退行性疾病提供新型靶向遞送策略。
六、丹麥Unisense電極數據的詳細解讀
1. 技術原理與實驗應用
電極型號:H?S-500微傳感器(方法章節2.3)。
檢測機制:
安培法實時監測H?S濃度(0-24小時)。
校準曲線:N?飽和緩沖液中的NaHS標準品(0.01 M)。
實驗場景:
體外:PBS中H?S@SF釋藥動力學(圖2F)。
體內:腦組織勻漿液H?S定量(圖6B)。
2. 關鍵結果與意義
體外緩釋驗證(圖2F):
H?S@SF組:8小時達峰(120 μM),24小時維持>50 μM。
NaHS組:2小時突釋(200 μM),4小時降至基線。
意義:Unisense數據直接證明SF水凝膠的緩釋能力,避免H?S毒性峰值。
體內生物分布(圖6B):
紋狀體H?S濃度:H?S@SF組(85 μM) vs. NaHS組(30 μM)。
空間特異性:皮層/海馬H?S濃度顯著高于小腦(p<0.01)。
意義:首次實現腦區H?S動態定量,證實局部注射的靶向性優勢。
3. 研究價值
技術優勢:
高靈敏度:檢測限0.1 μM,優于熒光探針(背景干擾大)。
動態監測:連續記錄避免離體采樣誤差。
機制關聯:體內H?S濃度與焦亡抑制程度正相關(r=0.89, p<0.001),為“劑量-效應”提供直接證據。
局限:需組織勻漿處理,無法實時活體監測。
4. 對臨床的啟示
替代技術:開發植入式H?S微電極,實現治療全程監控。
精準醫療:Unisense數據指導優化H?S劑量,避免神經毒性(H?S>100 μM可抑制線粒體呼吸)。
總結:本研究通過Unisense電極精準量化H?S@SF的緩釋特性與腦內分布,揭示其通過內源性H?S通路抑制焦亡的神經保護機制。