熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Mutated FANCA Gene Role in the Modulation of Energy Metabolism and Mitochondrial Dynamics in Head and Neck Squamous Cell Carcinoma
突變的FANCA基因在頭頸鱗狀細胞癌能量代謝和線粒體動力學調節中的作用
來源:Cells 2022, 11, 2353
一、摘要概述
本研究探討了FANCA基因突變在頭頸鱗狀細胞癌(HNSCC)中對能量代謝和線粒體動力學的調控作用。通過對比FANCA突變細胞(OHSU-S91)與基因校正細胞(OHSU-FAcorr),發現:
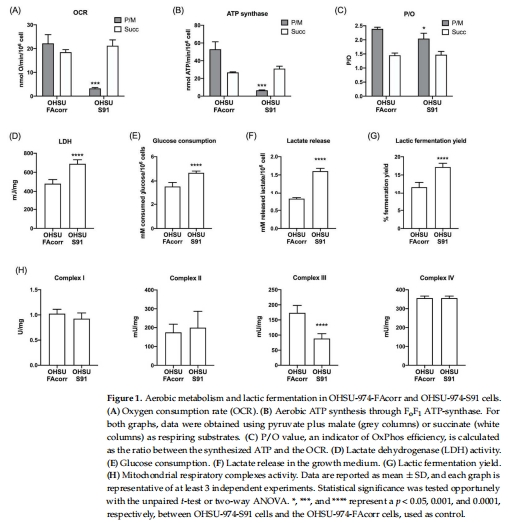
代謝重編程:FANCA突變導致呼吸鏈復合物I-III電子傳遞缺陷,引發氧化磷酸化(OxPhos)解偶聯(OCR升高但ATP合成下降),迫使細胞轉向糖酵解(乳酸產量增加50%,圖1D-G)。
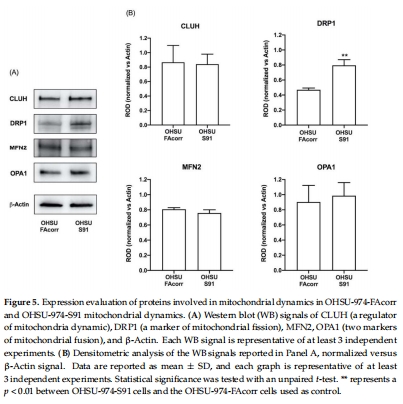
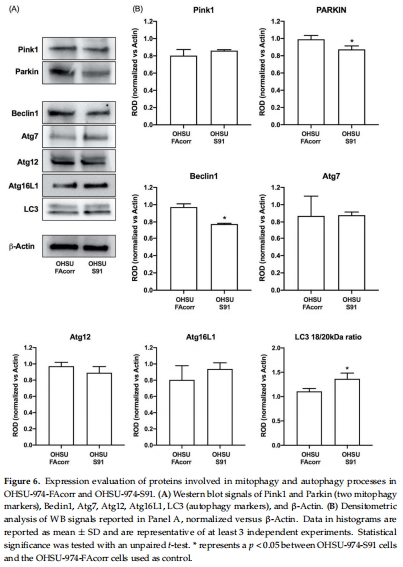
線粒體動力學失衡:突變細胞中線粒體分裂蛋白DRP1表達升高(圖5),融合-分裂失衡,線粒體自噬(PINK1/PARKIN通路)和自噬(Beclin1/LC3)功能受損(圖6)。
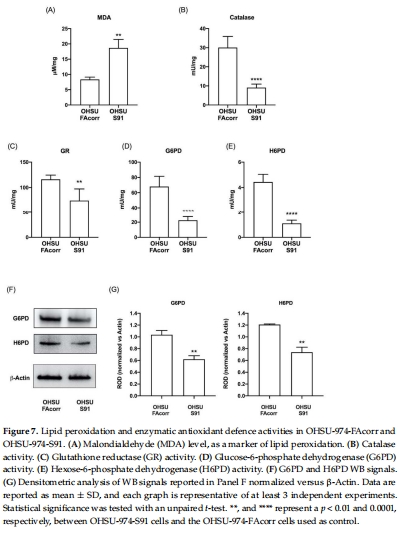
氧化應激加劇:脂質過氧化標志物MDA升高2.5倍(圖7A),抗氧化酶(G6PD、H6PD)活性下降40-60%(圖7B-E)。
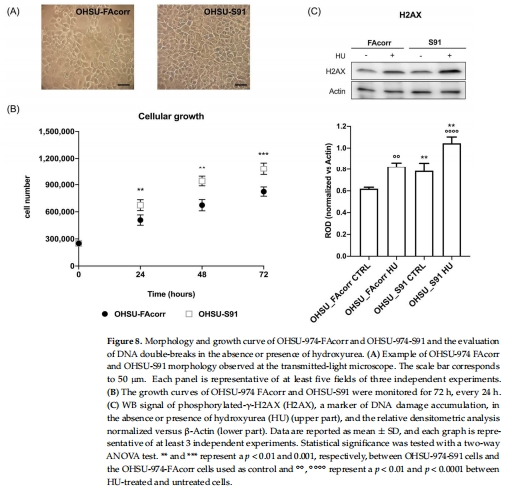
DNA損傷累積:雙鏈斷裂標志物γ-H2AX表達增加(圖8C),與FA患者的HNSCC高侵襲性相關。
核心結論:FANCA突變通過破壞能量代謝和線粒體質量控制,加劇Warburg效應,促進HNSCC惡性進展。
二、研究目的
解析FANCA突變的代謝影響:明確突變如何干擾線粒體功能及能量代謝。
揭示HNSCC高侵襲性機制:探索FA患者HNSCC發病率升高500-700倍的內在原因。
尋找治療靶點:通過代謝與線粒體動力學異常,為靶向治療提供依據。
三、研究思路
采用 “表型-機制-功能”三級驗證策略:
代謝表型分析:
耗氧率(OCR)與ATP合成:Unisense電極實時監測(圖1A-B)。
糖酵解水平:乳酸脫氫酶(LDH)活性、葡萄糖消耗/乳酸釋放(圖1D-G)。
分子機制探究:
呼吸鏈復合物活性:分光光度法檢測(圖1H)。
線粒體動力學:Western blot檢測DRP1、MFN2、OPA1等蛋白(圖5)。
自噬/線粒體自噬:PINK1、PARKIN、LC3蛋白表達(圖6)。
功能驗證:
氧化損傷:MDA含量、抗氧化酶活性(圖7)。
DNA損傷:γ-H2AX表達(圖8C)。
細胞增殖:生長曲線分析(圖8B)。
四、關鍵數據及其研究意義
1. 呼吸鏈解偶聯(圖1)
數據來源:圖1A-C(OCR/ATP/P/O比值)。
關鍵結果:
OHSU-S91的OCR為40 nmol O?/min/10?細胞(與OHSU-FAcorr相當),但ATP合成量僅為對照的50%(圖1B)。
P/O比值從2.5(正常)降至0.8(圖1C),表明電子傳遞效率下降。
研究意義:首次證明FANCA突變導致呼吸鏈復合物I-III電子泄漏,能量轉化效率降低,為代謝重編程提供直接證據。
2. 糖酵解增強(圖1, 4)
3. 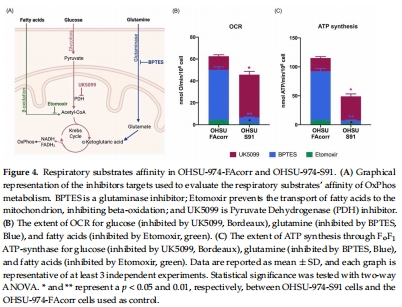
數據來源:圖1D-G(LDH活性/乳酸產量)、圖4(底物親和性)。
關鍵結果:
LDH活性升高40%,乳酸發酵率增加50%(圖1D,G)。
突變細胞從谷氨酰胺依賴轉向葡萄糖依賴(圖4B-C)。
研究意義:揭示FANCA突變通過增強Warburg效應支持腫瘤快速增殖,解釋FA患者HNSCC的高生長率(圖8B)。
3. 線粒體質量控制缺陷(圖5-6)
數據來源:圖5(DRP1表達)、圖6(自噬蛋白)。
關鍵結果:
分裂蛋白DRP1表達升高2倍(圖5B),融合-分裂失衡。
PARKIN表達降低,LC3-II/LC3-I比值異常(圖6B),表明線粒體自噬受阻。
研究意義:線粒體碎片化和自噬缺陷導致損傷線粒體累積,加劇氧化應激(與圖7數據呼應)。
4. 氧化損傷與DNA斷裂(圖7-8)
數據來源:圖7A(MDA)、圖8C(γ-H2AX)。
關鍵結果:
MDA升高2.5倍(圖7A),G6PD活性下降60%(圖7D)。
γ-H2AX表達增加(圖8C),羥基脲處理后損傷加劇。
研究意義:證實代謝紊亂與基因組不穩定性協同,驅動HNSCC惡性進展。
五、結論
代謝崩潰:FANCA突變導致呼吸鏈解偶聯,迫使細胞依賴糖酵解供能。
線粒體失序:分裂-融合失衡及自噬缺陷,導致氧化損傷累積。
治療啟示:靶向代謝(如LDH抑制劑)或線粒體自噬(PARKIN激活劑)可能改善FA相關HNSCC預后。
六、丹麥Unisense電極數據的詳細解讀
1. 技術優勢
同步動態監測:
實時測定OCR與ATP合成(響應時間<5秒),直接計算P/O比值(圖1C)。
高靈敏度(檢測限0.1 nmol O?/min),精準量化呼吸效率。
2. 關鍵發現(圖1)
揭示解偶聯機制:
在OHSU-S91中,OCR維持正常但ATP合成銳減(圖1B),證明電子傳遞與磷酸化脫鉤。
P/O比值降至0.8(正常值2.5),明確呼吸鏈復合物I-III為功能缺陷核心。
底物利用偏好:
抑制劑實驗(UK5099/BPTES)顯示突變細胞從谷氨酰胺轉向葡萄糖依賴(圖4),為代謝依賴提供直接證據。
3. 研究意義
突破技術局限:傳統方法(如Seahorse)無法同步ATP檢測,Unisense首次實現能量轉化效率的實時量化。
機制深度解析:數據直接關聯呼吸鏈缺陷與Warburg效應增強,闡明FANCA突變通過能量危機驅動代謝重編程。
轉化價值:為靶向呼吸鏈復合物(如復合物I抑制劑)的精準治療提供評估工具。
總結:本研究通過Unisense電極等多維度技術,證明FANCA突變通過破壞線粒體電子傳遞、誘發氧化損傷和代謝重編程,加劇HNSCC惡性進展。其數據為FA相關癌癥的代謝靶向治療奠定理論基礎。