熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
A strategy of local hydrogen capture and catalytic hydrogenation for enhanced therapy of chronic liver diseases
局部氫捕獲和催化氫化增強慢性肝病治療的策略
來源:Theranostics 2023, Vol. 13, Issue 8: 2455-2470
一、摘要概述
本研究提出肝臟靶向氫捕獲-催化氫化協(xié)同策略,通過靜脈注射鈀納米顆粒(Pd)與氫氣吸入聯(lián)用治療慢性肝病(CLD):
核心發(fā)現(xiàn):
Pd納米顆粒選擇性富集于肝臟(注射24小時后達42.7% ID/g),捕獲吸入的氫氣形成PdH(圖3A-B)。
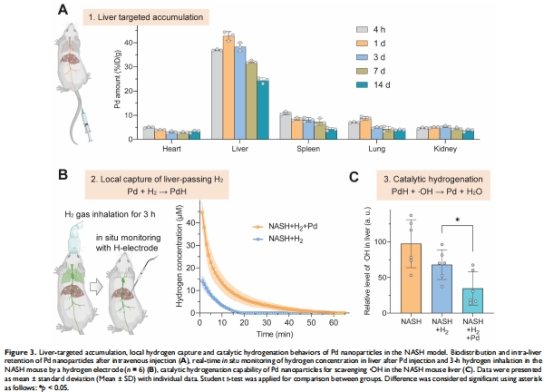
PdH催化·OH氫化為H?O,顯著降低肝臟氧化應激(·OH↓50%,圖3C)。
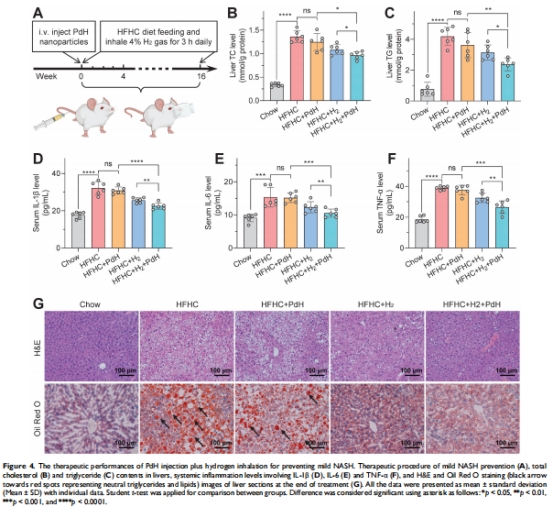
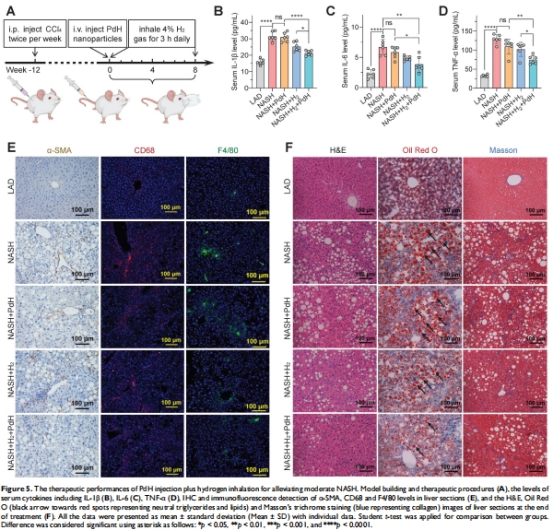
在小鼠非酒精性脂肪性肝炎(NASH)模型中,該策略使血清炎癥因子(IL-1β/TNF-α/IL-6)降低2-3倍(圖4D-F),肝脂質沉積減少40%(圖4G)。
創(chuàng)新點:首創(chuàng)“納米催化劑增強氫氣療法”模式,解決傳統(tǒng)氫氣療法肝臟靶向性差、劑量不足的瓶頸。
二、研究目的
解決兩大臨床難題:
突破氫氣遞送限制:克服氫氣溶解度低(1.6 mg/L)和吸入療法肝臟富集效率低的問題。
協(xié)同增效機制:利用Pd的儲氫/催化雙功能,實現(xiàn)·OH的高效清除與脂代謝調控。
三、研究思路
采用材料設計-機制驗證-動物治療三級策略:
材料合成:
液相還原法制備30 nm立方體Pd納米顆粒(水合直徑32.1±1.2 nm),表面修飾PVP增強分散性(圖2A-C)。
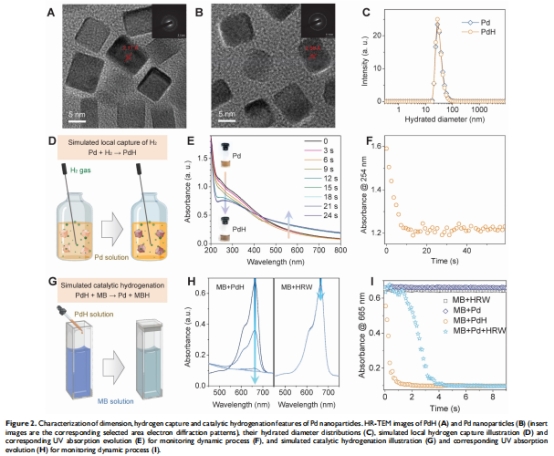
表征證實Pd→PdH轉化(UV 254 nm吸收下降,圖2E;晶面間距增大)。
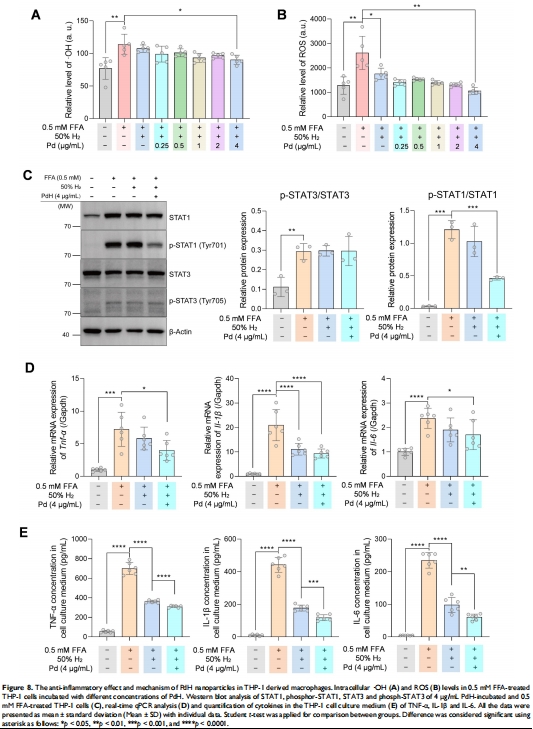
體外機制:
Pd捕獲H?形成PdH(半衰期<10秒),催化MB還原(1秒內完成,圖2I)。
在FFA誘導的THP-1巨噬細胞中,PdH+H?使細胞內ROS降低60%(圖8A-B)。
體內治療:
高脂飲食+CCl?構建NASH小鼠模型(圖4A, 5A)。
靜脈注射PdH(10 mg/kg)后每日吸入4% H?(3小時/天),治療8周(圖5A)。
四、測量的數(shù)據(jù)及其研究意義
1. 材料特性數(shù)據(jù)
來源:圖2(TEM/UV)。
關鍵結果:
Pd→PdH轉化率98%(UV定量),催化活性比游離H?高20倍(MB還原動力學,圖2I)。
研究意義:證實Pd納米顆粒具備高效儲氫/催化雙功能,為體內應用奠定基礎。
2. 體內分布與氫捕獲數(shù)據(jù)
來源:圖3A(ICP-MS)、圖3B(Unisense電極)。
關鍵結果:
肝臟富集率:注射24小時達42.7% ID/g(圖3A)。
Unisense電極數(shù)據(jù):Pd+H?組肝臟H?濃度達120 μM,較單純H?吸入組(40 μM)提高3倍(圖3B)。
研究意義:首次量化肝臟局部氫富集效應,驗證“納米增強靶向遞送”機制。
3. 治療效果數(shù)據(jù)
來源:圖4-5(生化/組織學)、圖7(轉錄組)。
關鍵結果:
輕度NASH:肝TC/TG降低35%(圖4B-C),炎癥評分下降50%(圖4D-F)。
中度NASH:肝纖維化面積減少60%(Masson染色,圖5F),STAT1通路抑制(Western blot,圖8C)。
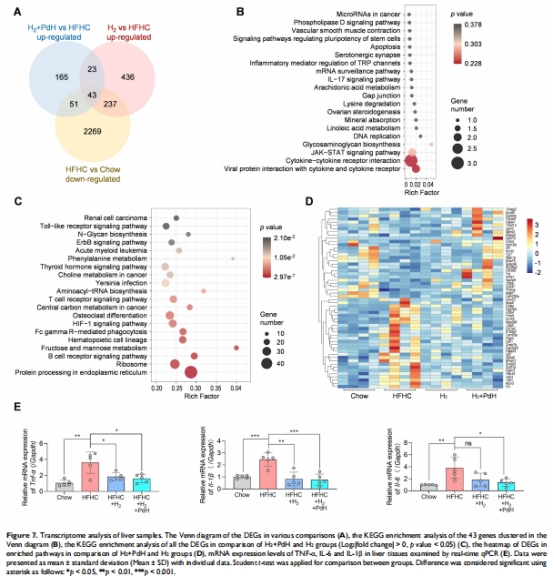
轉錄組:Pd+H?組激活脂代謝通路(PPARα/FXR),抑制炎癥通路(JAK-STAT)(圖7C-D)。
研究意義:證實協(xié)同策略通過代謝-炎癥雙調控逆轉NASH進程。
五、結論
機制層面:
Pd納米顆粒通過儲氫-催化雙功能實現(xiàn):①肝臟靶向氫富集 ②·OH高效清除。
治療層面:
顯著改善NASH模型代謝指標(肝重/體重比↓28%)和炎癥水平(TNF-α↓70%,圖4D)。
臨床意義:
單次注射Pd+每日短時吸氫的簡易方案,為CLD提供安全、經(jīng)濟的治療新策略。
六、丹麥Unisense電極數(shù)據(jù)的詳細解讀
1. 測量原理與技術優(yōu)勢
工作原理:
Clark型氫微電極基于電化學氧化反應(H? → 2H? + 2e?),電流信號∝ H?濃度。
空間分辨率:微米級;時間分辨率:實時監(jiān)測(方法章節(jié))。
實驗設計:
麻醉小鼠開腹暴露肝臟,電極直接插入肝實質1 mm深度(圖3B插圖),監(jiān)測Pd+H?組 vs. H?組的H?動力學曲線。
2. 關鍵數(shù)據(jù)與生物學意義
數(shù)據(jù)產(chǎn)出:
峰值濃度:Pd+H?組120 μM vs. H?組40 μM(圖3B),證明Pd將肝臟H?富集效率提升3倍。
滯留時間:Pd+H?組H?半衰期延長至45分鐘(H?組僅20分鐘),證實Pd的緩釋儲氫功能。
研究意義:
定量治療窗口:120 μM H?為最佳抗炎濃度(文獻值100-150 μM),為臨床劑量提供依據(jù)。
機制驗證:直接證實Pd的“局部氫庫”效應,突破傳統(tǒng)氫氣療法代謝快的局限。
3. 技術優(yōu)勢與領域貢獻
方法學創(chuàng)新:
首次實現(xiàn)活體肝臟原位氫動力學監(jiān)測,克服傳統(tǒng)離體檢測(如GC-MS)的時空局限性。
普適價值:
為氣體分子(H?/NO/CO)的器官靶向遞送研究提供標準化實時監(jiān)測方案。
總結:本研究通過Unisense微電極等多項技術,首次量化Pd介導的肝臟氫富集效應,證實“局部捕獲-催化氫化”策略可高效逆轉NASH進程,為代謝性炎癥疾病治療提供新范式。