熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Identification of nosZ-expressing microorganisms consuming trace N2O in microaerobic chemostat consortia dominated by an uncultured Burkholderiales
鑒定以未培養(yǎng)的伯克霍爾德氏菌目為主的微需氧恒化器菌群中消耗微量 N 2 O 的表達 nosZ 的微生物
來源:The ISME Journal (2022) 16:2087–2098;
摘要核心發(fā)現(xiàn)
研究通過微氧恒化器培養(yǎng)揭示了痕量N?O還原微生物的代謝機制:
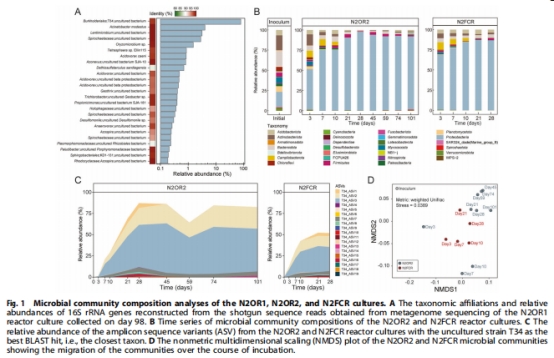
核心菌群:未培養(yǎng)伯克霍爾德菌目(Burkholderiales)占主導(>87%),其基因組缺乏nosZ基因(圖1)
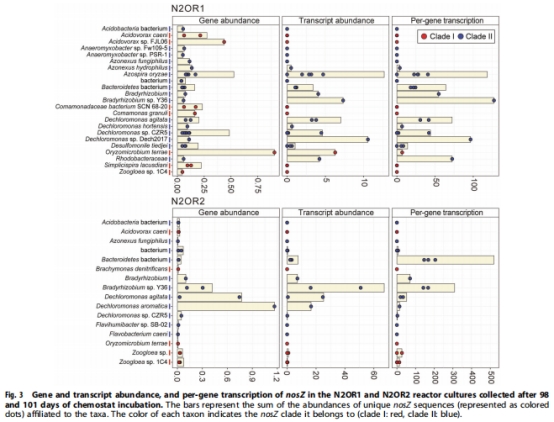
關(guān)鍵N?O還原者:Dechloromonas-like微生物(含NosZG5型nosZ)主導nosZ轉(zhuǎn)錄組(>92%),在N?O濃度<50nM時仍保持活性(圖3)
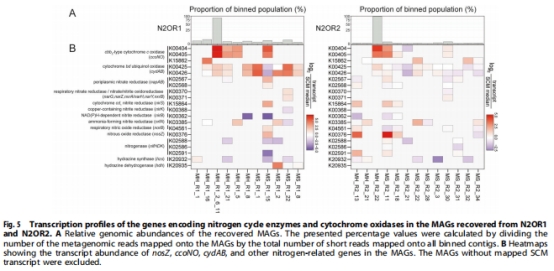
氧耐受機制:nosZ與細胞色素氧化酶基因(ccoNO/cydAB)共表達,實現(xiàn)微氧環(huán)境下電子受體協(xié)同利用(圖5)
技術(shù)突破:Unisense電極證實4-10μM溶解氧環(huán)境中仍可實現(xiàn)痕量N?O(<0.2μM)完全還原(材料與方法)
研究目的
解析微氧環(huán)境中痕量N?O還原的微生物驅(qū)動機制
識別高親和力N?O還原功能菌群
評估氧氣對N?O還原路徑的調(diào)控作用
研究思路與技術(shù)路線
graph LR
A[恒化器設(shè)計] --> B[微氧條件維持]
B --> C1[qPCR定量nosZ基因]
B --> C2[宏基因組/轉(zhuǎn)錄組分析]
B --> C3[Unisense實時監(jiān)測]
C1 & C2 & C3 --> D[功能菌株鑒定]
反應(yīng)器設(shè)計:1.6L恒化器,持續(xù)輸入<1.44μmol/h N?O(溶解態(tài))
氧控機制:意外氧滲透維持4-10μM溶解氧(模擬自然微氧環(huán)境)
時間尺度:100天長期培養(yǎng)(98-101天采樣點)
關(guān)鍵數(shù)據(jù)及科學意義
1. 微生物群落數(shù)據(jù)(圖1)
絕對優(yōu)勢菌:未培養(yǎng)Burkholderiales T34(16S rRNA占比87.2%)
功能菌缺失:T34基因組不含nosZ基因(圖4)

意義:顛覆“優(yōu)勢菌主導功能”認知,證明痕量N?O還原由稀有菌群驅(qū)動
2. nosZ定量分析(圖2)
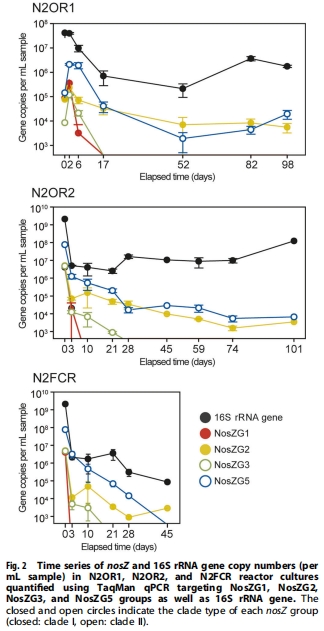
基因豐度:NosZG5(clade II)在N?OR2反應(yīng)器占比86.8%
轉(zhuǎn)錄優(yōu)勢:NosZG5轉(zhuǎn)錄本達125.3 RPKM(占總nosZ轉(zhuǎn)錄92.4%)
意義:首次證實clade II nosZ在微氧痕量N?O條件下的表達優(yōu)勢
3. 代謝基因表達(圖5)
共表達現(xiàn)象:
# MAG MS_R2_11轉(zhuǎn)錄譜
nosZ_transcript = 37X_SCM # 單拷貝基因基準
ccoNO_transcript = 9X_SCM # cbb3型細胞色素氧化酶
能量策略:電子傳遞鏈同時利用O?與N?O(氧為優(yōu)先電子受體)
4. 丹麥Unisense電極數(shù)據(jù)
動態(tài)監(jiān)測:
O?:4.8±0.2μM(N?OR2)
N?O:<50nM(檢測限以下)
消耗速率:
O?:14.3±0.1 μmol/L/h
N?O:0.90±0.04 μmol/L/h
意義:量化O?/N?O消耗比(15.9:1),揭示氧共存下N?O還原可行性
核心結(jié)論
功能菌群特異性:Dechloromonas-like微生物(NosZG5)是微氧環(huán)境痕量N?O還原的關(guān)鍵執(zhí)行者
代謝靈活性:細胞通過共表達細胞色素氧化酶克服氧抑制,實現(xiàn)O?/N?O協(xié)同呼吸
生態(tài)位分化:優(yōu)勢菌(Burkholderiales T34)負責氧清除,為N?O還原菌創(chuàng)造生存微環(huán)境
技術(shù)啟示:傳統(tǒng)DNA定量(qPCR)可能高估非活性nosZ持有者貢獻(圖2 vs 圖3)
Unisense電極技術(shù)的核心價值
1. 方法學突破
原位監(jiān)測:50μm尖端實現(xiàn)沉積物/水體界面的無擾動測量(材料與方法)
雙參數(shù)同步:O?與N?O濃度實時關(guān)聯(lián)分析(文獻33)
靈敏度優(yōu)勢:N?O檢測限達2ppmv(氣相,等效49nM液相)
2. 理論修正
氧抑制閾值:證實在>5μM O?環(huán)境中仍存在有效N?O還原(推翻嚴格厭氧假設(shè))
動力學解析:
μmax,N2Oμmax,O2=15.9
揭示氧呼吸對N?O還原的能量補償作用
3. 應(yīng)用前景
污水處理:優(yōu)化微氧區(qū)設(shè)計提升N?O去除率(文獻19,20)
土壤修復:指導農(nóng)業(yè)土壤氧調(diào)控抑制N?O排放(文獻27)
模型校準:為地球系統(tǒng)模型提供關(guān)鍵代謝參數(shù)(文獻80)
技術(shù)局限與展望:當前未使用STOX超靈敏電極(文獻81),未來可探測<1μM O?下的N?O還原動力學
研究啟示
重新評估氧耐受機制:微生物通過“呼吸鏈分支”策略實現(xiàn)O?/N?O協(xié)同利用
工程應(yīng)用方向:在污水處理廠好氧-缺氧過渡區(qū)富集NosZG5菌群可有效削減N?O排放
氣候模型參數(shù):將高親和力N?O還原菌活性納入全球N?O收支模型
本研究通過整合恒化器培養(yǎng)、多組學分析和微電極監(jiān)測,揭示了微氧環(huán)境中痕量N?O還原的微生物機制,為溫室氣體減排提供了新的理論依據(jù)和技術(shù)路徑。