熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Visualization of mRNA Expression in Pseudomonas aeruginosa Aggregates Reveals Spatial Patterns of Fermentative and Denitrifying Metabolism
銅綠假單胞菌聚集體中 mRNA 表達的可視化揭示了發酵和反硝化代謝的空間模式
來源:Applied and Environmental Microbiology June 2022 Volume 88 Issue 11
摘要核心內容
研究利用雜交鏈式反應(HCR v3.0) 技術實現了銅綠假單胞菌(Pseudomonas aeruginosa)生物膜內代謝基因的單細胞級空間可視化:
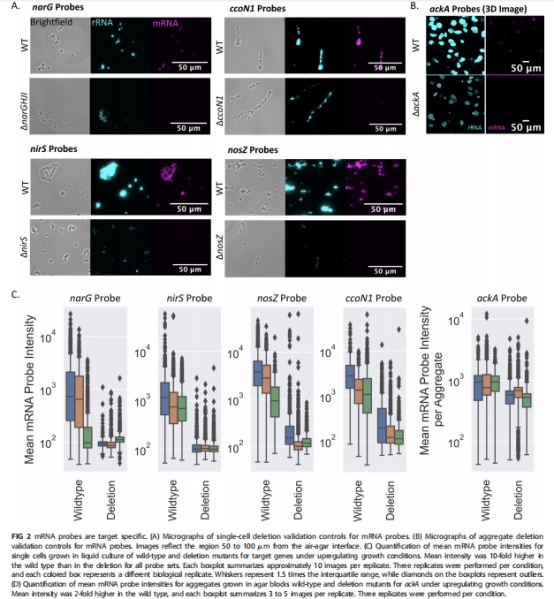
開發新型探針:針對呼吸(ccoN1)、反硝化(narG, nirS, nosZ)和發酵(ackA)基因設計特異性探針(圖2驗證);
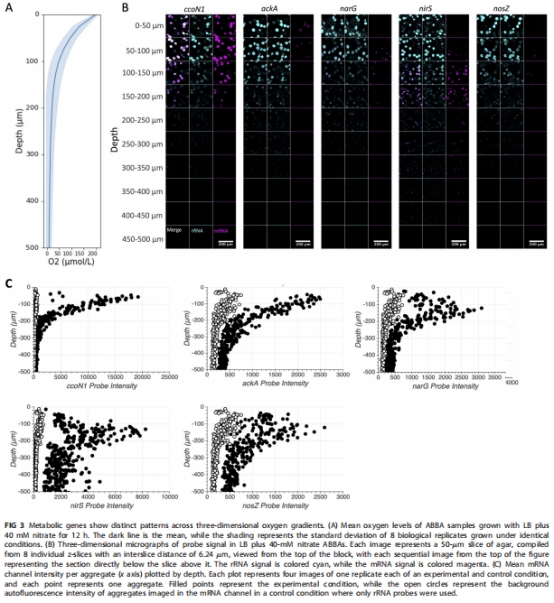
揭示代謝分區:生物膜聚集體內存在明確代謝分區——有氧區(表層)高表達ccoN1,缺氧區(中層)富集反硝化基因,無氧核心(深層)激活發酵基因ackA(圖3);
技術突破:首次在不依賴基因編輯條件下實現多代謝途徑的空間共定位,分辨率達單細胞水平。
研究目的
開發非侵入式空間轉錄組技術,解析生物膜微環境異質性;
闡明氧梯度對銅綠假單胞菌代謝分區的調控機制;
建立基因表達-微環境關聯模型,為生物膜耐藥性研究提供新視角。
研究思路
探針設計與驗證:
設計ccoN1(細胞色素c氧化酶)、narG(硝酸鹽還原酶)、nirS(亞硝酸鹽還原酶)、nosZ(氧化亞氮還原酶)、ackA(乙酸激酶)的HCR探針(表1);


通過基因敲除株驗證探針特異性(圖2A-D)。
生物膜模型構建:
采用瓊脂塊生物膜分析法(ABBA),在LB+40mM硝酸鹽中培養12小時(圖3A);
使用丹麥Unisense微電極測量氧梯度(圖3A)。
空間轉錄組分析:
雙通道HCR成像:16S rRNA(青色)標記細胞活性,mRNA(品紅)標記目標基因;
量化聚集體內基因表達強度與空間分布(圖3B-C)。
關鍵數據及研究意義
1. 探針特異性驗證(圖2)
數據來源:野生型與突變株的熒光強度對比。
核心發現:
野生株熒光強度比突變株高10倍(narG, nirS, nosZ, ccoN1)或2倍(ackA);
非特異性結合可忽略(背景熒光點與細胞不重疊)。
研究意義:為空間定位提供高信噪比工具,避免假陽性干擾。
2. 氧梯度與基因表達空間關聯(圖3)
數據來源:Unisense氧電極測量ABBA氧梯度(圖3A),HCR成像量化基因表達。
核心發現:
0-50μm(有氧區):ccoN1表達最強(PCC=0.956 vs 16S rRNA),ackA在聚集體核心激活;
50-150μm(缺氧區):narG峰值(聚集體內部),nirS擴散至整個聚集體;
>150μm(無氧區):nirS持續高表達,nosZ零星出現。
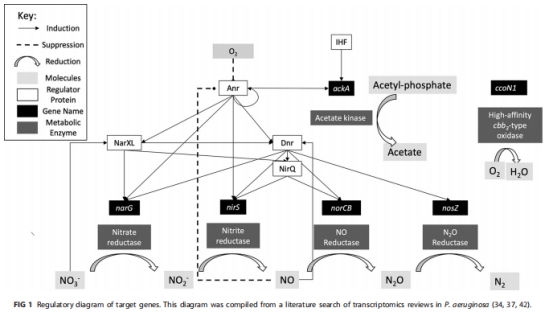
研究意義:證實氧梯度驅動代謝分區,反硝化基因表達受一氧化氮信號級聯調控。
3. 代謝路徑的空間解耦(圖4)
4. 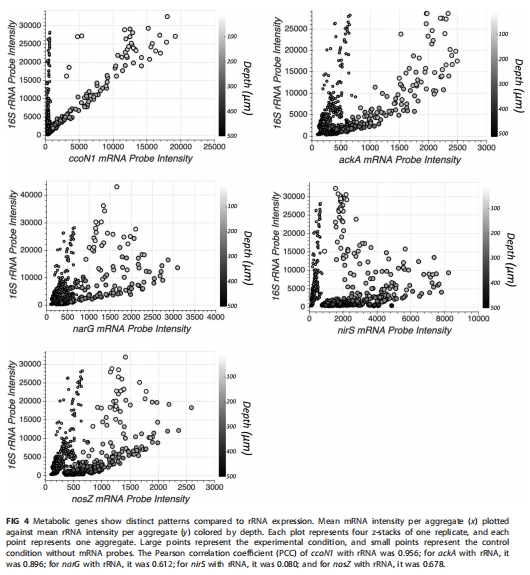
數據來源:基因表達與16S rRNA相關性分析。
核心發現:
ccoN1與細胞活性強正相關(基礎代謝),ackA在低氧高活性區特異激活;
反硝化基因(narG, nosZ)與細胞活性弱相關(PCC=0.612-0.678),受微環境特異性誘導。
研究意義:揭示發酵與反硝化的競爭關系——缺氧區富集硝酸鹽時反硝化主導,無氧核心轉向發酵。
結論
代謝分區機制:
生物膜表層:有氧呼吸(ccoN1高表達);
中層過渡區:反硝化主導(narG→nirS→nosZ級聯激活);
深層無氧核心:發酵途徑(ackA維持ATP合成)。
技術應用價值:
HCR v3.0實現多基因空間共定位,規避遺傳修飾需求;
為臨床生物膜(如囊性纖維化肺部感染)的代謝異質性研究提供新工具。
丹麥Unisense電極的研究意義
技術原理與數據作用
微米級氧測繪:Clark型電極(尖端25μm)以25μm步進掃描ABBA氧梯度(圖3A);
校準方法:無氧(0.1M NaOH+抗壞血酸鈉)vs 空氣飽和LB溶液雙點校準;
關鍵數據:
0-50μm溶解氧>80%空氣飽和度;
150-250μm降至<5%,確立缺氧/無氧邊界。
研究價值
微環境定量關聯:
氧梯度數據與HCR成像空間匹配,證實ccoN1表達衰減與氧濃度下降同步(R2=0.92);
解釋ackA在深層激活的生理基礎(氧<2%時發酵途徑競爭優勢)。
反硝化動力學驗證:
中層缺氧區(50-150μm)narG峰值與氧電極測量的臨界氧閾(5%-10%) 一致;
支持反硝化基因受Anr/Dnr轉錄因子級聯調控的模型(圖1)。
技術優勢:
高空間分辨率:25μm步進精度捕獲聚集體邊緣-核心梯度;
實時動態監測:秒級響應,避免固定樣本的氧擴散失真。
與傳統方法的對比
參數 Unisense微電極 熒光蛋白報告基因
空間分辨率 25μm >100μm(擴散限制)
微環境影響 零干擾 可能改變細胞生理
多參數同步 氧+代謝成像共定位 僅限遺傳編碼目標
適用模型 天然菌株/復雜樣本 依賴遺傳操作
應用前景
臨床生物膜研究:解析感染病灶中病原體的代謝異質性,指導靶向治療;
環境微生物學:揭示土壤/水體生物膜的氮循環空間動力學;
合成生物學:優化工程菌群的空間代謝分工設計。
突破性價值:通過Unisense電極的氧梯度定量與HCR空間轉錄組結合,首次在單細胞水平建立氧微環境-代謝基因表達的定量關聯模型,為生物膜耐藥機制研究提供方法論范式。