熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
標題:Unimolecular Self-Assembled Hemicyanine-Oleic Acid Conjugate Acts as a Novel Succinate Dehydrogenase Inhibitor to Amplify Photodynamic Therapy and Eliminate Cancer Stem Cells
單分子自組裝半菁-油酸偶聯物作為一種新型琥珀酸脫氫酶抑制劑,可放大光動力療法
期刊:Wang et al. 2023
摘要內容
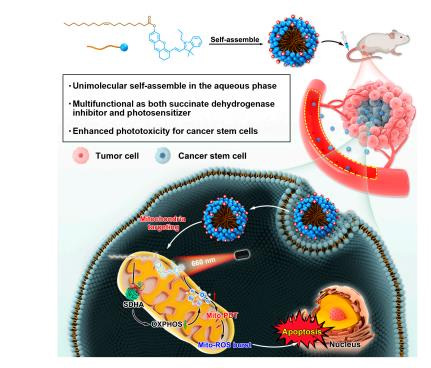
本研究開發了一種新型線粒體靶向的自組裝納米顆粒(CyOA NPs),由血青素-油酸共軛物(hemicyanine-oleic acid conjugate)構成,無需外源輔料即可自組裝成超分子納米顆粒。CyOA NPs具有雙重功能:
抑制氧化磷酸化(OXPHOS):靶向線粒體復合物II的琥珀酸脫氫酶(SDHA),降低氧氣消耗,逆轉腫瘤缺氧;
增強光動力療法(PDT):在660 nm激光照射下產生線粒體活性氧(Mito-ROS),顯著殺傷乳腺癌干細胞(BCSCs)。
在4T1乳腺癌模型和BCSC模型中,CyOA NPs的抑瘤效果和抗轉移能力均優于臨床光敏劑Hiporfin,且無顯著毒性。
研究目的
解決傳統光動力療法(PDT)的固有瓶頸:
活性氧(ROS)壽命短、擴散距離有限;
實體瘤缺氧環境限制PDT療效;
癌癥干細胞(CSCs)對常規治療的耐藥性。
研究思路
分子設計:
將油酸(oleic acid)與血青素染料(IR780/IR783衍生物)共軛,合成 CyOA 和 SO?-CyOA(圖2A)。
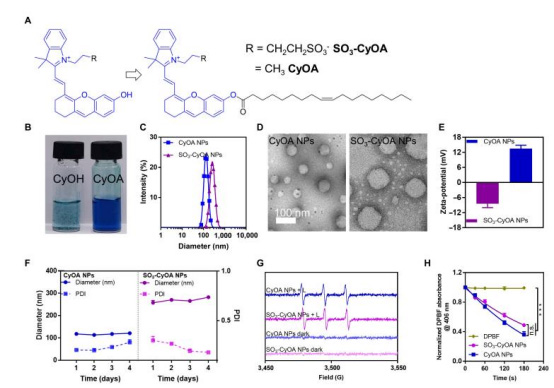
利用油酸的疏水性驅動自組裝形成納米顆粒(CyOA NPs/SO?-CyOA NPs)。
機制驗證:
缺氧逆轉:證實CyOA靶向SDHA抑制OXPHOS,降低氧氣消耗(圖3C-E);
線粒體靶向PDT:CyOA NPs富集于線粒體,激光照射后產生高濃度Mito-ROS(圖4B)。
療效評估:
體外:比較CyOA NPs與SO?-CyOA NPs對BCSCs的殺傷效果(圖4C-E);
體內:在4T1和BCSC移植瘤模型中評估抑瘤及抗轉移能力(圖5)。
測量數據及研究意義
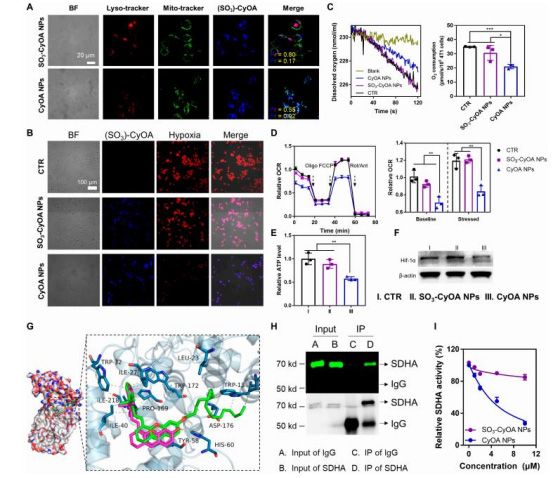
缺氧緩解與OXPHOS抑制(圖3)
數據:
Clark電極顯示CyOA NPs處理組細胞耗氧率降低40%(圖3C);
Seahorse分析表明CyOA抑制基礎/最大呼吸速率(圖3D);
ATP合成減少(圖3E),Hif-1α表達下調(圖3F)。
意義:首次發現CyOA直接結合SDHA(分子對接與免疫共沉淀驗證,圖3G-H),逆轉腫瘤缺氧,為PDT提供內源性氧氣支持。
ROS生成與細胞殺傷(圖4)
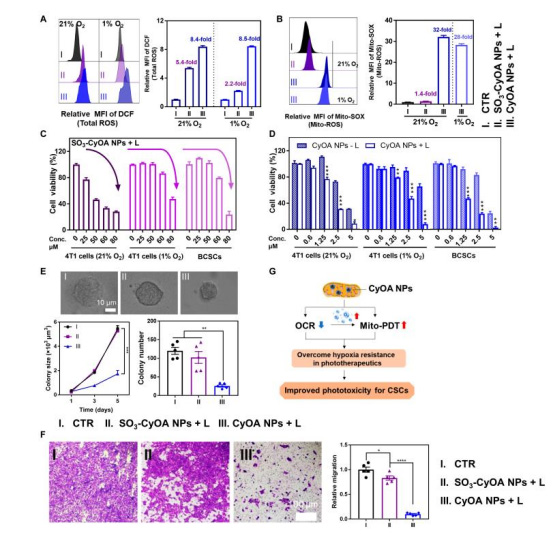
數據:
流式細胞術顯示CyOA NPs在缺氧下仍產生高水平Mito-ROS(32倍于對照組,圖4B);
對BCSCs的IC??為1.4 μM(SO?-CyOA NPs為70.6 μM),抑制乳腺球形成(圖4C-E)。
意義:缺氧耐受性PDT高效殺傷CSCs,克服傳統PDT瓶頸。
體內抗腫瘤效果(圖5)
數據:
CyOA NPs+L組在4T1模型中抑瘤率67%(Hiporfin組53%),肺轉移結節減少(圖5B-C, M-N);
BCSC模型中抑瘤率83%(圖5L),CD44?CD24? CSC比例下降62%(圖5F)。
意義:自組裝納米顆粒兼具靶向遞送、缺氧調節與PDT功能,顯著抑制腫瘤生長和轉移。
丹麥Unisense電極數據的詳細解讀
測量方法(Materials and Methods)
使用Unisense Clark氧電極直接監測細胞培養液中溶解氧濃度變化(圖3C)。
研究意義:
直接量化OXPHOS抑制:通過實時記錄氧氣消耗速率,證明CyOA NPs顯著降低細胞呼吸作用(40%降幅),為"氧氣節約"策略提供直接證據。
技術優勢:相較于間接檢測(如Hif-1α表達),Clark電極提供動態、高靈敏度的氧氣代謝數據,與Seahorse分析互補,共同驗證CyOA的OXPHOS抑制機制。
生理相關性:在近似生理條件下(37°C,密閉系統)測量,數據更貼近體內微環境,支持CyOA在實體瘤缺氧調控中的轉化價值。
結論
雙重功能分子設計:CyOA NPs是首個兼具SDHA抑制劑和線粒體靶向光敏劑的自組裝納米顆粒,通過抑制OXPHOS逆轉腫瘤缺氧,并增強PDT。
高效清除CSCs:對BCSCs的光毒性比SO?-CyOA NPs高50.4倍,顯著抑制乳腺球形成和腫瘤遷移。
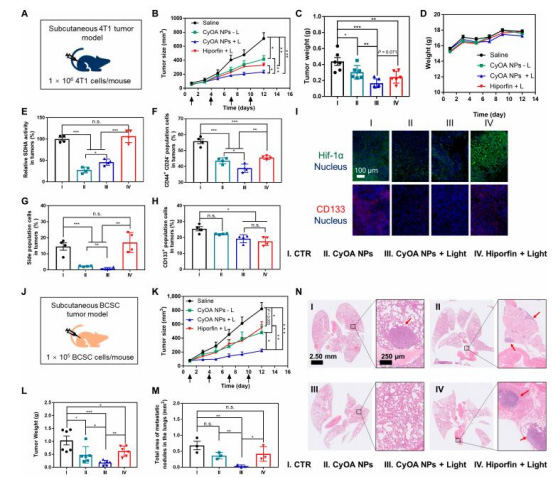
臨床轉化潛力:在移植瘤模型中療效優于臨床光敏劑Hiporfin,且無系統性毒性(圖5),為克服PDT耐藥性提供新策略。