熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Differential effects of purines and prostaglandins on hypoxia induced dilatation of porcine retinal vessels at different branching level ex vivo
嘌呤和前列腺素對缺氧誘導的豬視網膜血管不同分支水平擴張的差異效應
來源:Experimental Eye Research, Volume 234, 2023, Article 109584.
《實驗眼科研究》第234卷,2023年,文章編號109584
摘要內容
研究通過離體實驗探究缺氧條件下嘌呤(ATP、腺苷)和前列腺素(PGs)對豬視網膜不同層級血管(小動脈、前毛細血管小動脈、毛細血管)擴張的調控差異。主要發現:
小動脈:缺氧擴張受腺苷A2B受體拮抗劑抑制(p<0.01),而前列腺素EP2/EP3受體拮抗劑增強擴張(p<0.01)。
前毛細血管小動脈:EP2受體拮抗劑抑制擴張(p=0.04),EP1受體拮抗劑增強擴張(p=0.03)。
毛細血管:擴張程度顯著低于其他層級(p≤0.02),腺苷A3受體拮抗劑、環氧合酶抑制劑布洛芬聯合核苷酸酶抑制劑AOPCP、EP3受體拮抗劑均增強擴張(p<0.05)。
結論:缺氧誘導的視網膜血管擴張由嘌呤和前列腺素共同調控,但作用機制因血管分支層級而異。
研究目的
闡明嘌呤(ATP/腺苷)和前列腺素在視網膜缺氧性血管擴張中的角色。
揭示不同血管層級(小動脈、前毛細血管小動脈、毛細血管)對缺氧反應的調控差異。
解析特定受體亞型(如腺苷A2B/A3、前列腺素EP1-EP4)的層級特異性作用。
研究思路
離體血管模型:取豬眼視網膜上象限,保留完整血管樹(主小動脈至毛細血管),灌注生理鹽溶液。
缺氧誘導:氣體混合系統切換至低氧(95% N? + 5% CO?),氧分壓從20.8%降至6.2%(Unisense氧電極監測)。
藥物干預:
嘌呤通路:拮抗劑包括核苷酸酶抑制劑AOPCP、P2受體拮抗劑PPADS、腺苷A2B受體拮抗劑MRS 1754、A3受體拮抗劑MRS 1523。
前列腺素通路:環氧合酶抑制劑布洛芬、EP1-EP4受體特異性拮抗劑(SC-19220、PF-04418948等)。
血管直徑測量:熒光顯微成像結合ARIA軟件量化三級血管直徑(圖2),數據以KPSS最大收縮為0%、EDTA最大擴張為100%標準化。

測量數據、來源及研究意義
血管擴張率(圖3):
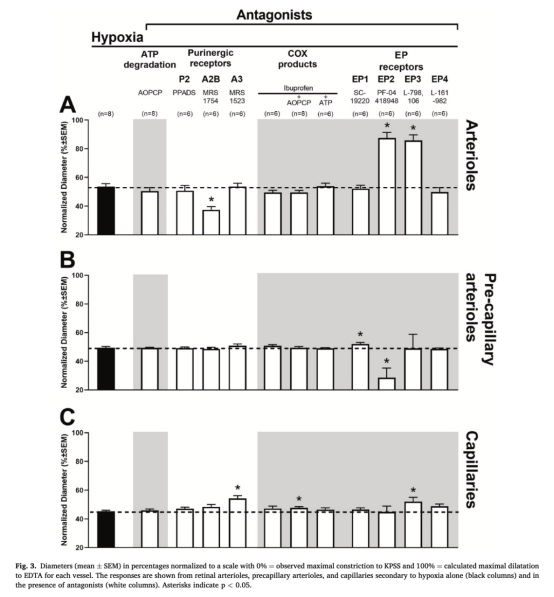
數據:缺氧時小動脈擴張53.7±2.1%,前毛細血管小動脈擴張約40%,毛細血管擴張顯著更低(未量化具體值)。
意義:量化血管層級對缺氧反應的敏感性梯度,提示血流調控的解剖學基礎。
受體拮抗效應(圖3):
小動脈:A2B拮抗劑(MRS 1754)使擴張降至37.4±2.3%(p<0.01),EP2(PF-04418948)、EP3(L-798,106)拮抗劑增強擴張。
前毛細血管小動脈:EP2拮抗劑抑制擴張,EP1拮抗劑(SC-19220)增強擴張。
毛細血管:A3拮抗劑(MRS 1523)、布洛芬+AOPCP、EP3拮抗劑均顯著增強擴張。
意義:揭示嘌呤(A2B/A3)和前列腺素(EP1-EP3)受體在血管層級的特異性分布與功能差異。
最大擴張基準:
數據:建立EDTA最大擴張與KPSS收縮的線性關系(小動脈:y=0.42x+57.4;毛細血管:y=0.97x+0.95)。
意義:解決缺氧干擾傳統擴張劑(罌粟堿)的問題,提供標準化測量框架。
結論
層級特異性調控:
小動脈擴張依賴腺苷A2B受體,受前列腺素EP2/EP3受體負向調控。
前毛細血管小動脈受前列腺素EP1(抑制性)和EP2(促進性)受體雙向調節。
毛細血管擴張受腺苷A3受體和前列腺素EP3受體抑制,且對缺氧反應最弱。
通路交互:前列腺素可能通過抑制嘌呤信號(如布洛芬+AOPCP增強毛細血管擴張)參與調控。
生理意義:視網膜血流調控存在微解剖分區,不同血管層級采用差異化的缺氧適應策略。
丹麥Unisense電極測量數據的研究意義
實驗中采用Unisense OXY-Meter結合微氧電極監測組織氧分壓,其核心價值在于:
實時動態監測:
精確量化缺氧干預效果(氧分壓從20.8%降至6.2%),確保實驗條件的一致性。
空間分辨率保障:
微電極可定位測量視網膜局部氧環境,避免整體腔室測量忽略微區域差異。
技術必要性:
傳統氧電極無法滿足離體視網膜薄組織的精準監測,Unisense微電極提供μm級分辨能力。
機制關聯驗證:
氧分壓數據與血管擴張響應的直接關聯(如毛細血管低反應性對應局部氧需求差異),為層級特異性結論提供環境參數支撐。