熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Hydrogen production by a fully de novo enzyme (微生物產氫)通過完全從頭酶制氫
來源:Dalton Trans., 2024, 53, 12905–12916
1. 論文摘要核心內容
研究對象:基于全新設計的三α螺旋蛋白(a3C)和鈷基催化劑(鈷肟,cobaloxime)構建的人工酶。
核心發現:該人工酶在中性水溶液中通過電化學、光化學和化學還原三種途徑高效催化產氫(HER)。
創新點:首次證明小分子從頭合成蛋白(de novo protein)可作為酶支架,用于開發生物啟發的可持續產氫系統。
性能:產氫轉化數(TON)達游離鈷肟的80%,但速率為其40%,表明蛋白環境對催化動力學有調控作用。
2. 研究目的
解決關鍵挑戰:傳統鈷肟催化劑需有機溶劑且水相穩定性差,限制其實際應用。
核心目標:設計水溶性、基于豐產元素(Co)的人工氫酶,實現中性水中高效產氫。
科學意義:探索人工蛋白支架在優化催化劑性能(穩定性、效率)中的作用。
3. 研究思路
分子設計:
通過非天然氨基酸(3-甲基吡啶-半胱氨酸)將鈷肟共價錨定于a3C蛋白的32位點(圖1)。
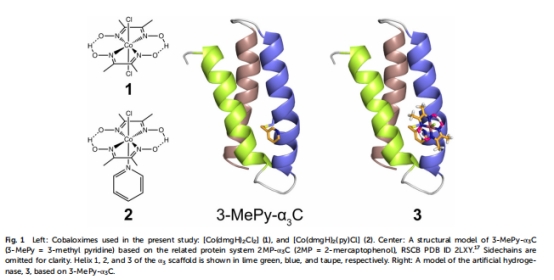
結構表征:
驗證鈷肟結合(質譜、UV-Vis)、蛋白折疊(圓二色譜)、鈷價態(EPR)及電化學行為(循環伏安)。
功能測試:
在電化學、光化學([Ru(bpy)?]2?/抗壞血酸體系)和化學還原([Eu(EGTA)]2?)條件下量化產氫性能。
機制分析:
對比游離鈷肟與人工酶的活性差異,探討蛋白微環境對催化動力學的影響。
4. 關鍵數據及研究意義
(1)結構表征數據
圖2A(MALDI-ToF-MS):
質譜峰證實鈷肟成功連接至蛋白(m/z 7550.5 → 鈷肟-蛋白復合物)。
意義:驗證人工酶合成路徑可行性。
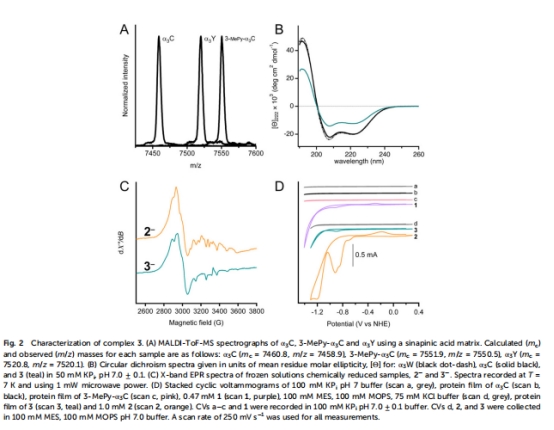
圖2B(圓二色譜):
鈷肟結合后α-螺旋含量降至50%(游離a3C為78%),但整體穩定性不變(ΔG~-4.3 kcal/mol)。
意義:蛋白結構可容忍金屬催化劑嵌入,維持基本折疊。
圖2C(EPR):
Co(II)信號(g≈2.3)證實還原態鈷中心存在,譜線差異表明蛋白環境限制溶劑配位。
意義:蛋白微環境調控鈷的配位結構。
圖2D(循環伏安):
人工酶(3)與游離鈷肟(2)還原電位相近(-0.90 V vs. NHE),但催化電流形狀不同。
意義:蛋白支架保留電催化活性,但影響電子傳遞路徑。
(2)產氫性能數據
光化學產氫(圖3B-C & 表1):
圖3B(Unisense實時監測):pH 6.2時,人工酶(3)TON=49(游離鈷肟TON=62)。
圖3C(GC終點檢測):pH 6時人工酶產氫量(41 μM H?/μM催化劑)略高于游離鈷肟(33 μM)。
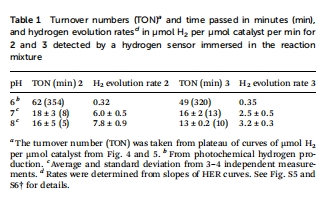
表1(動力學參數):pH 7時人工酶速率(2.5 μmol H?/min/μmol cat)為游離催化劑的40%。
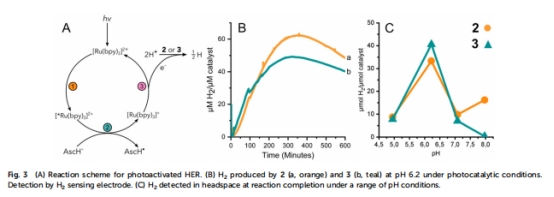
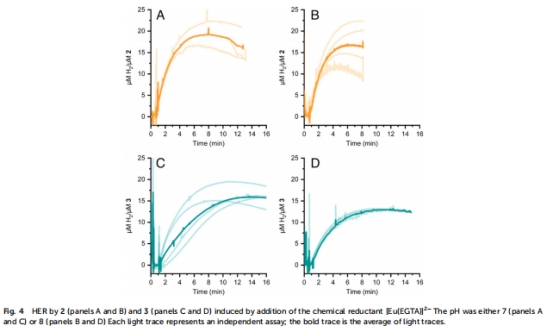
化學還原產氫(圖4 & 表1):
圖4A-B:[Eu(EGTA)]2?還原下,人工酶初始速率顯著低于游離鈷肟(pH 7: 6.0 vs 2.5 μmol/min/μmol cat)。
意義:蛋白環境減緩電子/質子傳遞,但提升pH適應性(pH 6活性反超)。
5. 核心結論
成功構建人工氫酶:首次將鈷肟整合至從頭設計蛋白支架,實現中性水中多途徑產氫。
蛋白支架的雙重作用:
優勢:提升催化劑水溶性及pH穩定性(pH 5-8保持活性),保護活性中心。
局限:空間位阻降低傳質速率,導致產氫速率下降至游離催化劑的40%。
應用潛力:小分子從頭合成蛋白(高效原子經濟性)可作為可擴展生物啟發催化劑的理想支架。
6. Unisense電極數據的詳細解讀與研究意義
數據來源
圖3B:光催化產氫的實時動力學曲線(Unisense H?微傳感器監測)。
圖4A-D:化學還原產氫的實時動力學曲線(同前)。
表1:基于Unisense數據的產氫速率(μmol H?/min/μmol cat)和TON。
研究意義
高時空分辨率動力學解析:
Unisense電極實現秒級實時監測溶解H?濃度,捕捉傳統GC無法獲得的初始速率信息(圖4A-B斜率)。
例:光催化中人工酶(3)的產氫滯后現象(圖3B),揭示蛋白環境導致電子傳遞延遲。
揭示pH依賴性的動態機制:
實時數據(表1)結合GC終點(圖3C)發現:
pH 6時人工酶活性反超游離催化劑 → 蛋白微環境優化局部質子傳遞。
pH >7時速率下降 → 游離鈷肟受限于Co-H形成能壘,而人工酶受蛋白剛性限制。
量化傳質限制效應:
化學還原中([Eu(EGTA)]2?過量),人工酶速率僅為游離催化劑40%(圖4),直接證明:
蛋白口袋的位阻效應是速率限制主因(非電子轉移能力)。
光催化中因還原劑濃度低,速率差異被掩蓋(表1)。
指導后續設計:
數據表明:需在蛋白口袋引入質子中繼基團(如Glu/Lys)或柔性結構域以平衡保護性與傳質效率。
技術優勢
無損原位監測:避免GC的取樣誤差,尤其適用于短壽命中間體研究。
高靈敏度:檢測限達μM級H?,精準量化低濃度催化活性。
總結
該研究通過整合結構生物學、電化學與實時傳感技術,證實從頭設計蛋白支架在可持續催化中的潛力。Unisense電極提供的動態動力學數是揭示蛋白微環境對傳質影響的關鍵,為下一代人工酶設計提供了實驗與理論基石。