熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Injectable Self-Oxygenating Cardio-Protective and Tissue Adhesive Silk-Based Hydrogel for Alleviating Ischemia After MI Injury
用于減輕心肌梗死后缺血的注射型自供氧心臟保護和組織粘附絲基水凝膠
來源:Small 2024, 2312261
《Small》期刊 2024年,文章編號2312261
摘要內容:
摘要描述了一種新型可注射絲素蛋白(SF)與酪胺修飾藻酸鹽(TA-Alg)的復合水凝膠(TSF),該水凝膠同時負載釋氧微顆粒(OMPs)和基質細胞衍生因子-1α(SDF)。該材料具備機械魯棒性、組織粘附性和緩釋特性,旨在通過持續釋放氧氣和SDF,在心肌梗死(MI)區域同步激活血管新生并改善缺氧微環境,從而減少細胞死亡、抑制纖維化瘢痕形成,促進心臟功能恢復。在大鼠MI模型中,該水凝膠使心肌細胞存活率提高≈30%,左心室收縮和舒張功能分別改善≈10%和20%,射血分數提高≈25%。
研究目的:
開發一種兼具持續供氧和心臟保護功能的可注射水凝膠,通過局部緩釋氧氣和SDF,協同促進MI后缺血區域的血管新生、減少心肌細胞凋亡、抑制纖維化,最終改善心臟功能。
研究思路:
材料設計與合成:
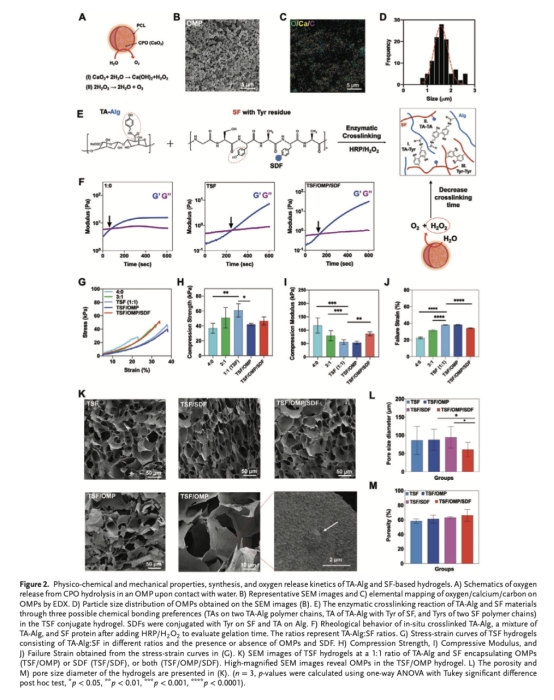
合成釋氧微顆粒(OMPs):通過雙乳液法包裹過氧化鈣(CPO)于聚己內酯(PCL)中(圖2A-D)。
制備酪胺修飾藻酸鹽(TA-Alg),并通過酶促交聯(HRP/H?O?)與絲素蛋白(SF)形成復合水凝膠(TSF)(圖2E)。
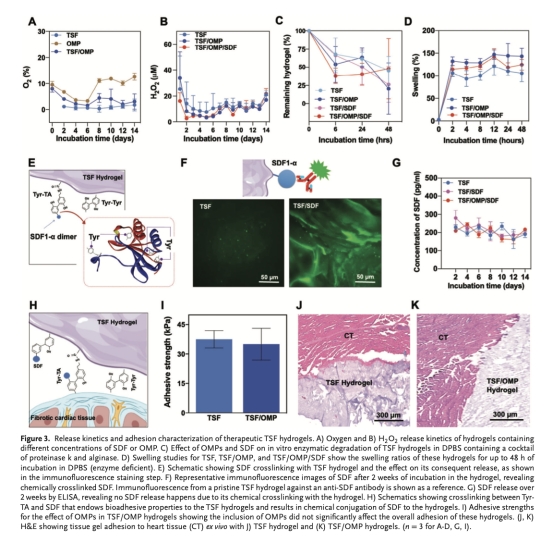
將OMPs和SDF化學交聯至TSF水凝膠中(TSF/OMP/SDF)(圖3E-H)。
材料表征:
測試水凝膠的機械性能(壓縮模量、粘附性)、孔隙結構、降解行為、氧氣/H?O?/SDF釋放動力學(圖2F-M,圖3A-G)。
體外驗證:
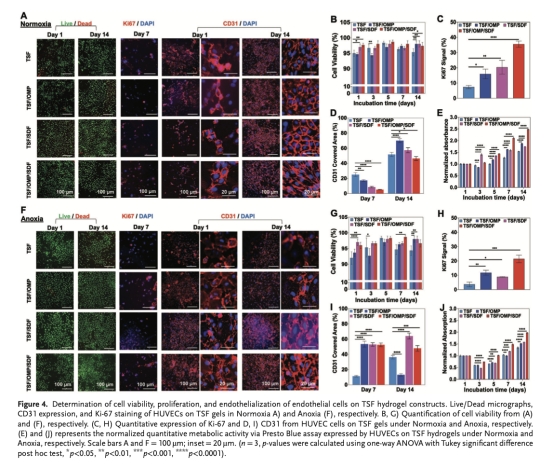
評估水凝膠在人臍靜脈內皮細胞(HUVECs)中的生物相容性、促內皮化(CD31表達)和缺氧條件下(0.5% O?)的細胞存活/增殖(Ki-67)(圖4)。
驗證水凝膠對誘導多能干細胞(iPSC)分化的心肌細胞(iCMs)搏動功能的促進作用。
體內療效評估:
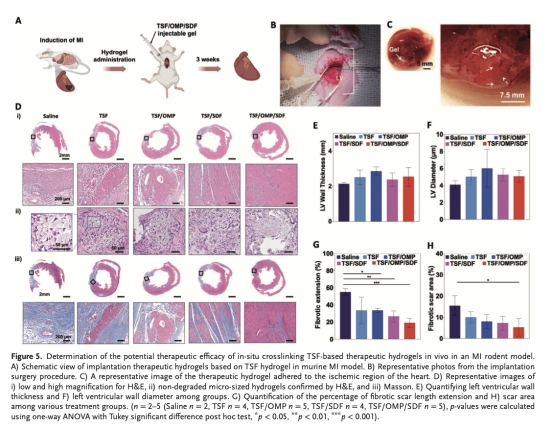
在大鼠MI模型(結扎左前降支)中注射水凝膠(圖5A-C)。
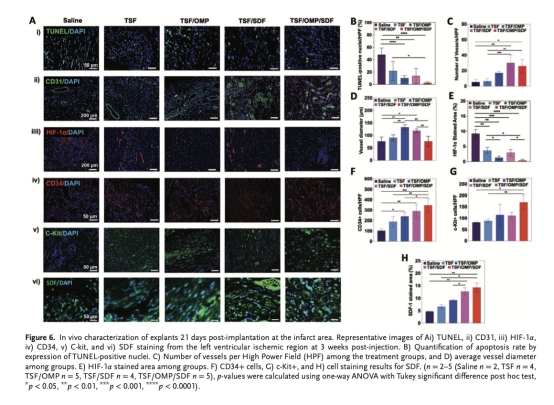
分析心臟組織學:纖維化面積(Masson染色)、細胞凋亡(TUNEL)、血管密度(CD31)、干細胞歸巢(CD34?/c-Kit?)、缺氧標志物(HIF-1α)及SDF滯留(圖5D-H,圖6)。
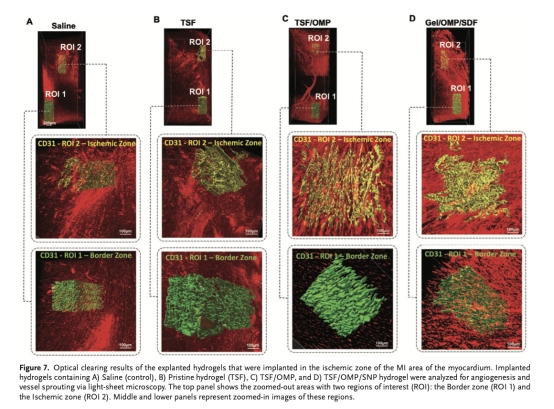
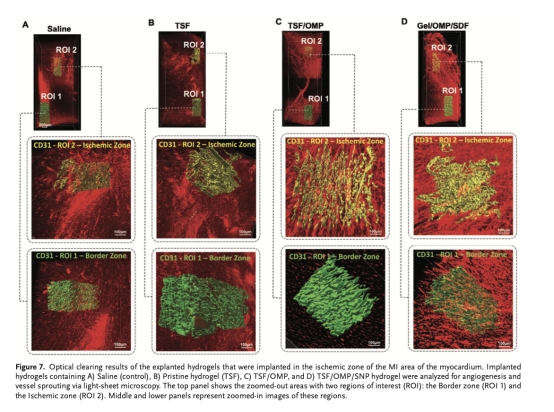
通過光片顯微鏡三維成像評估血管網絡(圖7)。
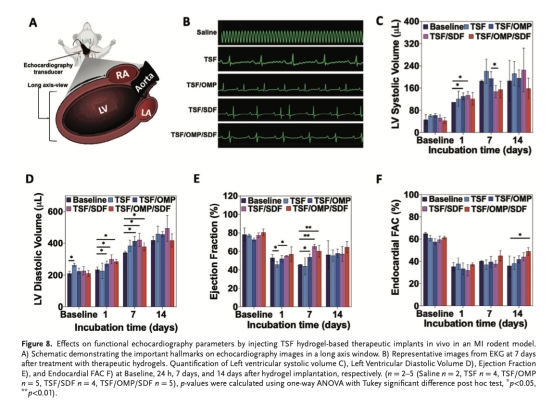
超聲心動圖監測心功能:射血分數(EF)、左心室收縮/舒張容積(LVSV/LVDV)(圖8)。
測量的數據及研究意義(關聯圖表):
材料物理化學數據
OMPs尺寸與形貌(圖2B-D):粒徑1.6±0.3 μm,球形結構,表面均勻分布氧元素。意義:確保可控緩釋氧氣。
水凝膠壓縮模量(圖2H-I):TSF/OMP/SDF模量最高(≈55.8 kPa)。意義:匹配心肌力學環境(30-70 kPa),提供機械支撐。
氧氣釋放動力學(圖3A):TSF/OMP水凝膠在14天內維持氧濃度<5%(低氧水平)。意義:避免缺氧細胞死亡,同時不抑制血管新生。
SDF滯留(圖3F-G):化學交聯使SDF穩定存在于水凝膠中(無釋放)。意義:確保SDF在MI部位長效招募干細胞。
體外細胞響應數據
HUVECs存活與內皮化(圖4B,D,G,I):在缺氧條件下,TSF/OMP/SDF顯著提升細胞存活率(>90%)和CD31表達。意義:證明水凝膠在缺氧微環境中促進血管生成。
iCMs搏動功能:TSF/OMP/SDF使搏動頻率達20次/分鐘(無OMP/SDF組無搏動)。意義:氧氣和SDF協同改善心肌細胞功能。
體內治療效果數據
纖維化面積(圖5H):TSF/OMP/SDF組瘢痕面積顯著低于對照組。意義:減少心肌組織不可逆損傷。
血管密度與直徑(圖6C-D):TSF/OMP/SDF組血管數量增加75%,血管成熟度提高。意義:促進功能性血管網絡重建。
凋亡率(圖6B):TSF/OMP/SDF組TUNEL?細胞<5%(對照組≈20%)。意義:顯著保護心肌細胞免于凋亡。
心功能(圖8C-E):治療后7天,TSF/OMP/SDF組射血分數(EF)提高≈25%,左心室收縮功能改善。意義:直接證實治療策略改善心臟泵血能力。
三維血管網絡(圖7):光片顯微鏡顯示TSF/OMP/SDF組血管分支增多、結構有序。意義:直觀驗證血管新生效果。
結論:
材料性能成功實現:開發的TSF/OMP/SDF水凝膠具備優異的機械強度(≈55.8 kPa)、組織粘附性(圖3I)及緩釋特性(氧氣維持<5%低氧水平14天,SDF化學錨定)。
協同治療機制:OMPs緩解MI區缺氧,SDF招募干細胞并促進血管新生,二者協同提升內皮細胞存活(缺氧下>90%)和心肌細胞功能(搏動頻率↑)。
顯著體內療效:在大鼠MI模型中,該水凝膠使血管密度增加75%,心肌細胞凋亡率降至<5%,纖維化面積減少,最終改善心功能(EF↑≈25%)。
轉化價值:為MI治療提供了一種可注射、多功能的生物材料策略,通過局部調控微環境促進心臟修復。
Unisense電極測量數據的研究意義詳細解讀:
數據內容(圖3A):使用丹麥Unisense Opto-F1光纖傳感器測量水凝膠在無氧PBS中的溶解氧濃度,顯示TSF/OMP水凝膠在14天內持續釋放氧氣,濃度穩定在3-5%(低氧水平)。
研究意義:
驗證低氧維持能力:MI核心區氧濃度常低于0.5%,而5%以下的低氧環境既能避免細胞死亡,又可激活促血管生成信號(如HIF-1α)。Unisense數據證明該水凝膠可將極端缺氧(anoxia)提升至生理性低氧(physiological hypoxia),為細胞存活提供適宜環境。
規避高氧毒性:傳統氧載體易因突釋造成局部高氧,引發氧化損傷。該數據表明OMPs通過PCL包裹實現可控緩釋,且濃度始終低于5%,避免ROS過量生成。
支持血管新生機制:低氧環境(3-5%)可上調VEGF等促血管因子,與SDF協同促進圖6C-D中的血管密度增加。Unisense數據為"OMPs通過創建低氧微環境增強血管化"的結論提供直接證據。
解釋體內HIF-1α調控(圖6E):水凝膠組HIF-1α表達低于對照組,因OMPs緩解了MI區的極端缺氧,避免HIF-1α持續高表達導致的細胞凋亡(與圖6B凋亡減少一致)。