熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Hydrogen-Generating Magnesium Alloy Seed Strand Sensitizes Solid Tumors to lodine-125 Brachytherapy
產氫鎂合金種子鏈增強實體瘤對碘-125近距離放射治療的敏感性
來源:Adv. Sci. 2024, 2412263
先進科學
摘要內容:
該研究開發了一種名為AMASS(AZ31鎂合金種子鏈)的新型裝置,由可降解的AZ31鎂合金管(AMAT)與放射性碘-125(12?I)種子交替連接而成。AMASS可通過微創手術植入腫瘤,在腫瘤微環境的酸性條件下緩慢釋放氫氣(H?)。體外實驗表明,AMAT降解產生的氫氣能協同12?I種子的輻射作用,顯著抑制腫瘤細胞增殖、促進凋亡、破壞氧化還原穩態和線粒體膜電位、降低ATP水平并增強DNA損傷。在小鼠異種移植瘤和兔肝腫瘤模型中,AMASS聯合12?I種子比單獨使用12?I種子療效更優,且無顯著副作用。AMASS還能確保輻射劑量均勻分布并簡化植入流程。
研究目的:
解決實體瘤對12?I種子近距離放療的放射抵抗性問題,通過鎂合金降解產生的氫氣增強放療敏感性,同時利用合金管的機械性能優化種子空間分布。
研究思路:
材料設計與表征:制備AZ31鎂合金管(AMAT)并與12?I種子組裝成AMASS,測試其力學性能(軸向力、彎曲強度等)和pH依賴的降解/產氫特性。
體外機制驗證:
構建體外氫放療裝置,驗證AMAT產氫對腫瘤細胞(HepG2、MC38、VX2)的放療增敏作用。
探究氫氣增敏機制:檢測ROS、線粒體膜電位(MMP)、ATP、DNA損傷(γH2AX)及凋亡相關蛋白表達。
體內療效評價:
小鼠皮下瘤模型:植入AMASS后監測瘤內氫氣濃度、腫瘤體積及組織病理變化。
兔肝腫瘤模型:通過CT和治療計劃系統(TPS)評估AMASS對種子分布均勻性的改善,并分析抑瘤效果及安全性(血常規、肝腎功能等)。
測量數據及研究意義(標注來源圖表):
力學性能(表1):

軸向最大力(88.83±6.24 N)、彎曲強度(204.67±13.61 MPa)等參數證明AMASS具備臨床植入所需的機械強度,防止種子移位。
降解與產氫特性(圖2 如下):
pH越低(5.6 vs 7.3),AMAT腐蝕越快,產氫速率越高(圖2c-f)。
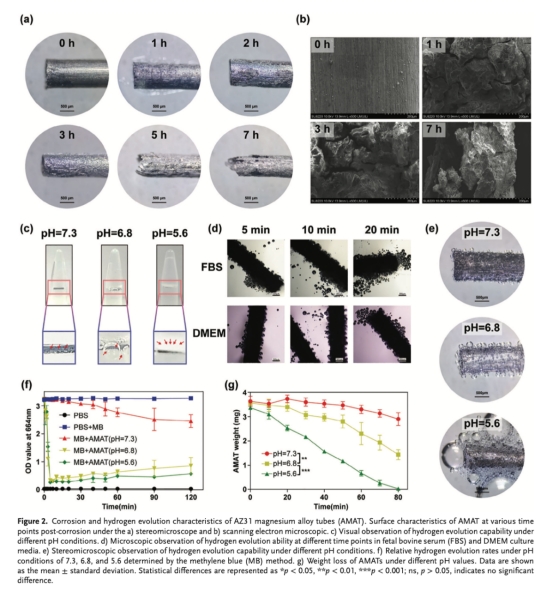
意義:腫瘤微環境(pH 6.4–7.0)可激活AMAT持續產氫,時間匹配12?I種子療效周期(3–4周)。
體外細胞實驗(圖3-4):
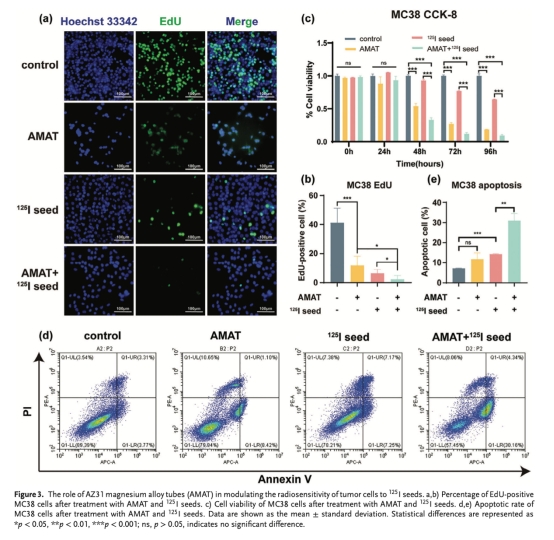
EdU/CCK-8實驗(圖3a-c 如下):AMAT+12?I顯著抑制細胞增殖(如MC48細胞72小時存活率降至40%)。
流式細胞術(圖3d-e 如下):聯合處理使MC38細胞凋亡率升至35.2%(單獨12?I為21.3%)。
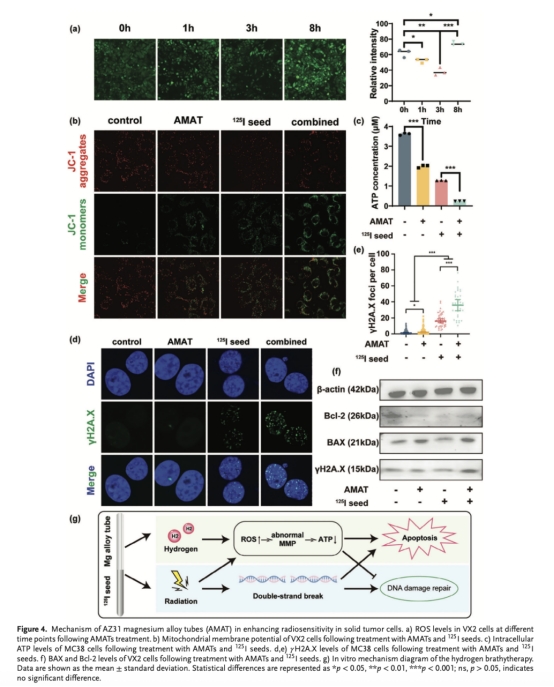
線粒體功能(圖4b-c):JC-1染色顯示MMP崩解,ATP水平下降50%。
DNA損傷(圖4d-e):γH2AX焦點數增加2倍,Western blot(圖4f)顯示BAX/Bcl-2比值升高,促凋亡通路激活。
小鼠體內氫氣監測(圖5a-b):
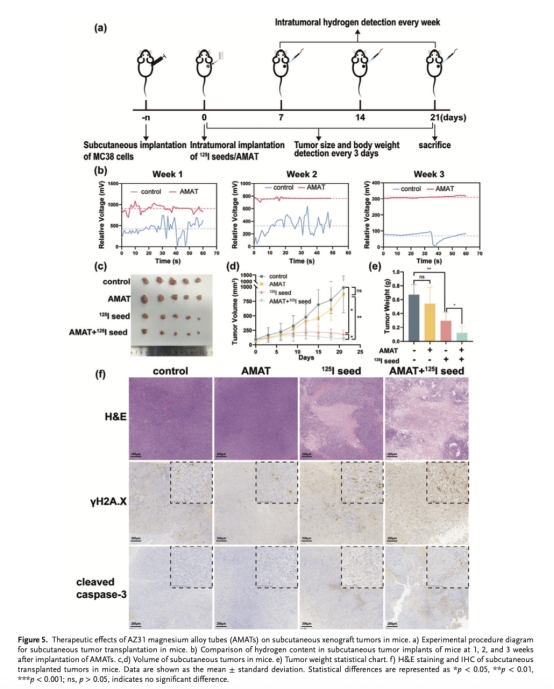
使用丹麥Unisense氫微電極檢測:植入AMASS的腫瘤內氫氣濃度持續高于對照組,第1/2/3周電壓差分別為475 mV、436 mV、240 mV。
Unisense電極數據的核心意義:
直接證實AMAT在體產氫:首次通過原位微電極技術動態量化腫瘤內氫氣濃度,排除間接推斷誤差。
明確產氫動力學:電壓差遞減(475→240 mV)反映AMAT隨降解產氫量逐漸下降,與材料3–4周降解周期一致,為療效時間窗提供依據。
關聯療效機制:高氫氣濃度期(第1–2周)與顯著抑瘤效果(圖5c-e)同步,證實氫氣是增敏放療的關鍵因素。
兔模型臨床轉化驗證(圖6 如下):
CT成像(圖6d如下):AMASS組種子分布均勻,單獨種子組出現遷移(3周時位移明顯)。
腫瘤體積(圖6e如下):AMASS組較單獨12?I組縮小50%。
安全性(圖6f-g 如下):血清鎂離子無升高,主要器官無毒性,證明生物安全性。
結論:
AMASS兼具力學支撐與pH響應產氫功能,可優化12?I種子空間分布并克服腫瘤放射抵抗。
氫氣通過破壞線粒體功能(降低MMP/ATP)和增強輻射DNA損傷(增加γH2AX),協同提升12?I種子療效。
動物實驗證實AMASS顯著抑制腫瘤生長,且無全身毒性,具備臨床轉化潛力。