熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
來源:International Journal of Obesity (2024) 48:512 – 522
1. 摘要核心內容
研究背景:肥胖通過脂肪組織(AT)缺氧誘發慢性炎癥,進而促進代謝功能障礙相關脂肪性肝病(MASLD)的發展。但缺氧在肥胖進展中的動態變化及其在肝臟與脂肪組織中的作用時序尚不明確。
方法:采用高脂高果糖飲食(HFHFD)喂養小鼠20周,監測不同時間點(4/8/12/16/20周)的代謝指標、組織缺氧(活體pO?測量)、基因表達及組織學變化,并利用膽堿缺乏高脂飲食(CDAHFD)非肥胖脂肪肝模型驗證。
關鍵結果:
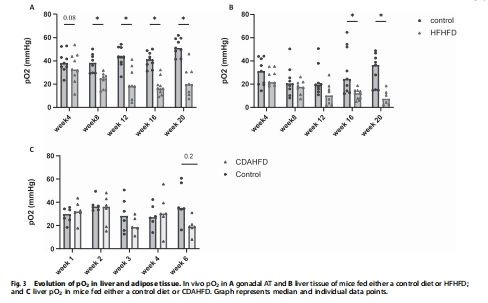
脂肪組織缺氧:第8周出現,隨肥胖進展持續加重(圖3A)。
肝臟缺氧:第16周才顯著出現(圖3B),此時處于早期MASLD(單純脂肪變性階段)。
非肥胖模型(CDAHFD):未檢測到顯著肝臟缺氧(圖3C),提示肥胖相關過程(如AT缺氧)是肝缺氧的前提。
結論:AT缺氧是肥胖早期事件,肝臟缺氧發生于肥胖后期但仍在MASLD早期;肥胖相關的AT缺氧是MASLD病理機制的關鍵環節。
2. 研究目的
核心問題:明確進行性肥胖過程中,脂肪組織與肝臟缺氧的發生時序及其在肥胖相關MASLD發展中的作用。
驗證假設:
AT缺氧是否早于肝臟缺氧?
肝臟缺氧是否在MASLD早期(無纖維化/炎癥階段)即存在?
缺氧是否依賴于肥胖相關代謝紊亂?
3. 研究思路
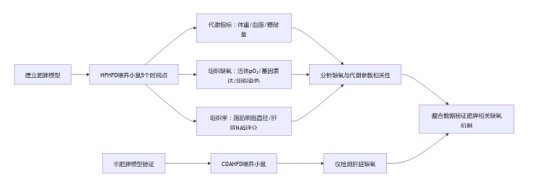
4. 測量數據及意義(附圖表來源)
檢測維度 具體指標 研究意義 數據來源
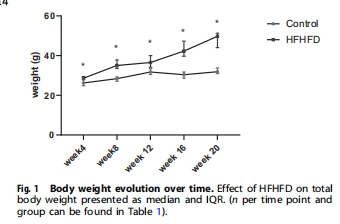
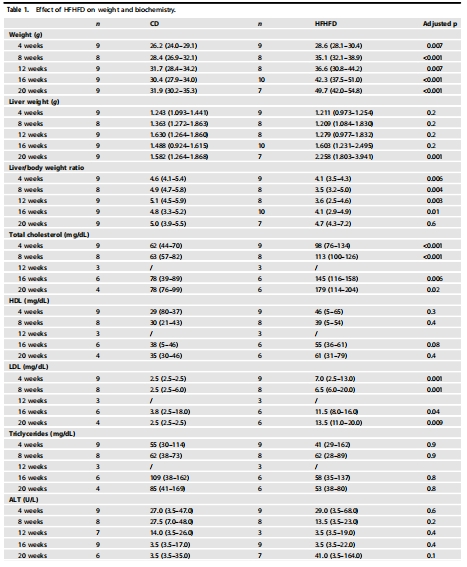
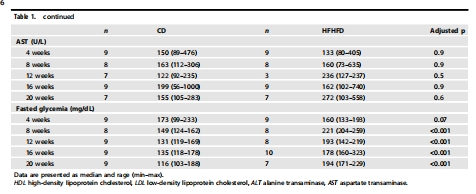
代謝表型 體重、血脂(TC/LDL↑)、胰島素抵抗 確認肥胖模型成功,代謝紊亂與缺氧關聯性 圖1, 表1, 圖S1
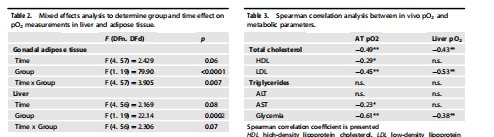
組織缺氧 活體pO?(Unisense電極) 直接定量缺氧程度,揭示AT與肝臟缺氧發生時序差異 圖3A, 3B, 表2
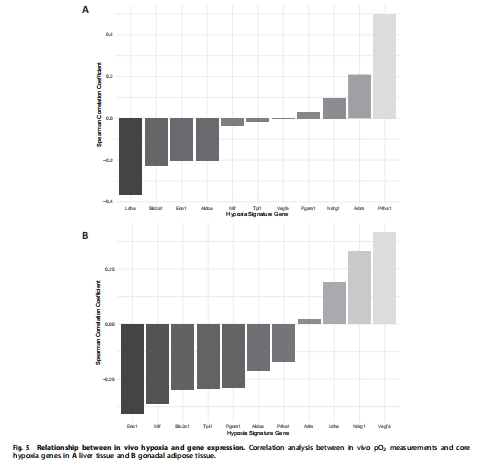
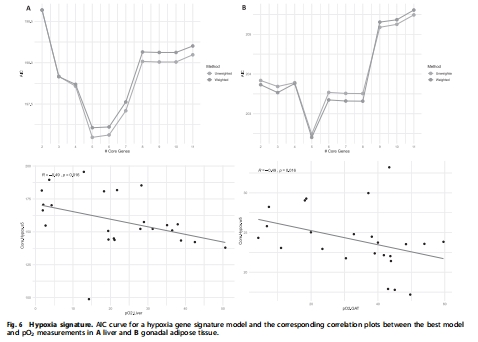
缺氧基因表達(PCR array) 驗證缺氧通路激活,建立缺氧特征基因模型(如AT中Slc2a1↑) 圖5, 圖6, 表S3-S4
組織染色(pimonidazole陽性面積) 間接證實缺氧,與pO?數據一致(AT中r=-0.27, p=0.02) 圖S3
組織病理 脂肪細胞直徑(AT肥大) 解釋缺氧機制:肥大>血管生成不足 圖S2
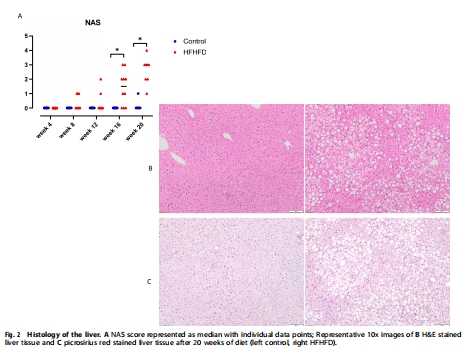
肝臟NAS評分(脂肪變性↑,無纖維化) 明確肝缺氧發生于MASLD早期(單純脂肪變性階段) 圖2, 表S1
非肥胖模型驗證 CDAHFD肝臟pO?(無顯著缺氧) 佐證肝缺氧需肥胖相關代謝背景(如AT缺氧),非單純肝損傷導致 圖3C, 表S2

5. 核心結論
缺氧發生時序:
脂肪組織:第8周出現缺氧(圖3A),隨肥胖持續惡化。
肝臟:第16周才顯著缺氧(圖3B),此時處于早期MASLD(單純脂肪變性,NAS=1.5)。
缺氧機制差異:
AT缺氧由脂肪細胞肥大 > 血管生成不足驅動。
肝缺氧與肥胖相關血流動力學改變(如肝內血管阻力↑)相關。
肥胖的關鍵作用:
非肥胖CDAHFD模型(嚴重MASH但無肥胖)未出現顯著肝缺氧(圖3C),表明肥胖相關過程(如AT缺氧)是肝缺氧的前提。
臨床意義:
AT缺氧是肥胖早期干預靶點,可能阻斷MASLD進展。
肝缺氧在單純脂肪變性階段已存在,或是推動MASH轉化的關鍵因素。
6. Unisense電極測量數據的詳細解讀
技術方法
設備:丹麥Unisense氧敏感微電極(Clark型,尖端直徑25μm)。
校準:21% O?水溶液(飽和氧)與無氧溶液(0.1M抗壞血酸鈉)雙點校準。
操作:
麻醉小鼠開腹后,微操縱器將電極插入性腺AT(2mm)或肝左葉(3mm后退0.5mm)。
每組織測3次,取90秒穩定信號均值。
研究意義
直接定量活體缺氧:
克服間接標志物(如HIF-1α)受多因素調控的局限,提供實時原位pO?值(單位:mmHg)。
圖3A/B顯示AT與肝pO?的動態下降趨勢,明確缺氧發生時序。
驗證缺氧病理機制:
pO?降低與脂肪細胞直徑↑(圖S2)、缺氧基因表達↑(如AT中Slc2a1,圖5B)、pimonidazole染色↑(圖S3)顯著相關,多維度交叉驗證結果可靠性。
揭示器官特異性:
AT pO?在第8周即顯著↓(早于肝),且與代謝參數(血糖↑、LDL↑)強相關(表3),提示AT缺氧是肥胖代謝紊亂的早期驅動因素。
支撐核心結論:
肝pO?在CDAHFD模型無變化(圖3C),排除單純肝損傷導致缺氧,突出肥胖微環境的重要性。
技術優勢
高空間分辨率:微電極尖端可定位特定組織區域(如肝小葉不同區帶)。
活體動態監測:避免離體組織氧擴散造成的測量偏差。
定量精準性:為基因表達和組織染色提供客觀基準,支撐后續缺氧特征基因模型的建立(圖6)。
總結
該研究通過Unisense活體pO?監測結合多組學分析,首次揭示肥胖發展中AT缺氧早于肝臟缺氧,且肝臟缺氧在MASLD早期(單純脂肪變性階段)即存在。非肥胖模型的陰性結果表明,肥胖相關AT缺氧是肝缺氧的必要條件,為靶向AT缺氧預防MASLD提供了理論依據。