熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
Intestine-Targeted Controlled Hydrogen-Releasing MgH?Microcapsules for Improving the Mitochondrial Metabolism of Inflammatory Bowel Disease
腸道靶向控氫釋放MgH2微膠囊改善炎癥性腸病線粒體代謝
來源:Advanced Functional Materials 2024,34,2316227
摘要核心內容
該論文開發了一種腸道靶向控釋氫氣的微膠囊(MgH2 EC ES),通過多層乳化法將MgH2顆粒封裝于乙基纖維素(EC)疏水網絡外層包覆腸溶材料Eudragit S100(ES)。該微膠囊在胃酸(pH 1.2)中穩定,在腸道(pH 7.0)中通過ES溶脹和EC的緩釋作用實現持續產氫。在小鼠結腸炎模型中,高劑量(800 mg/kg)的MgH2 EC ES微膠囊治療效果優于一線藥物5-ASA,顯著恢復結腸長度、黏膜屏障和線粒體能量代謝。機制研究表明,H?通過保護線粒體電子傳遞鏈復合物免受氧化損傷,增強腸道細胞的能量代謝以支持黏膜修復。
研究目的
核心問題:解決現有氫療法(如富氫水)的氫氣溶解度低、胃酸快速分解導致腸道遞送效率低的問題。
創新點:開發一種pH響應型腸道靶向遞送系統,實現氫氣在腸道的可控緩釋,并闡明H?通過保護線粒體功能改善結腸炎的機制。
研究思路
材料設計:
核心結構:MgH2作為高容量固態儲氫材料(產氫量923 mL/g),EC疏水網絡延緩水解,ES腸溶層防止胃酸分解。
合成方法:通過油-醇-油多步乳化法構建核殼結構(圖1a)。
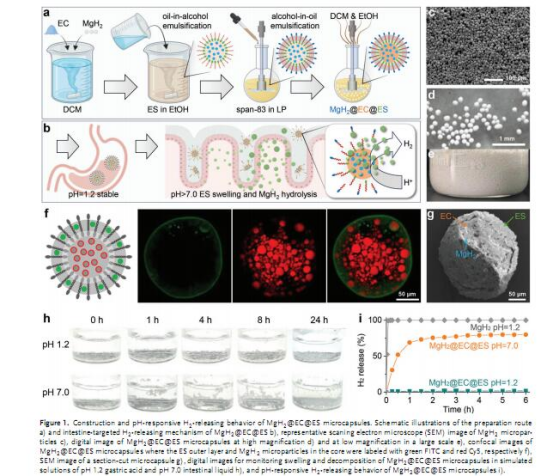
性能驗證:
體外實驗:驗證微膠囊的pH響應釋放行為(圖1h-i,圖S6)。
體內遞送:通過熒光成像(圖2a-c)和ICP檢測(圖S8)驗證腸道靶向性。
治療效果:在DSS誘導的小鼠結腸炎模型中評估體重、DAI評分、結腸長度、組織病理學等指標(圖3)。
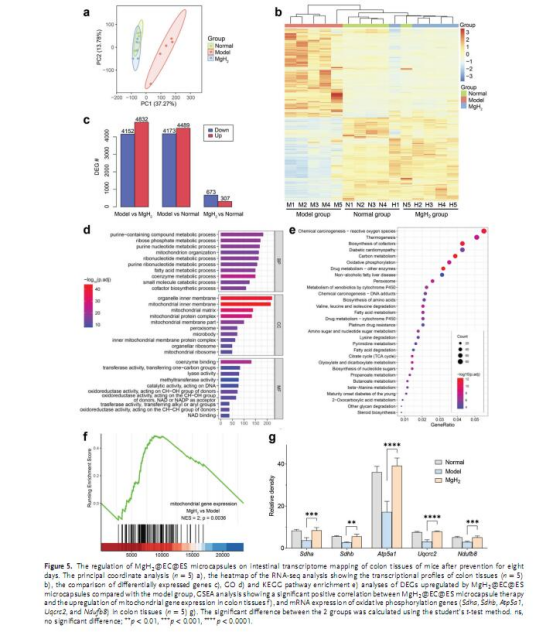
機制研究:通過RNA測序、線粒體ATP檢測、Western blot等手段揭示H?對線粒體復合物的保護作用(圖5-6)。
關鍵數據及其研究意義
結構與釋放性能:
圖1c-g:SEM和共聚焦圖像顯示微膠囊的核殼結構,MgH2顆粒被EC/ES包裹。
圖1i:體外模擬腸道液中,MgH2 EC ES在6小時內釋放80%的H?,而裸MgH2在胃酸中5分鐘完全分解。
意義:驗證了微膠囊的pH響應性和緩釋能力。
體內遞送與H?濃度:
圖2d:Unisense電極檢測顯示,口服微膠囊后6小時結腸H?濃度達到飽和(約1.6 ppm),顯著高于胃部。
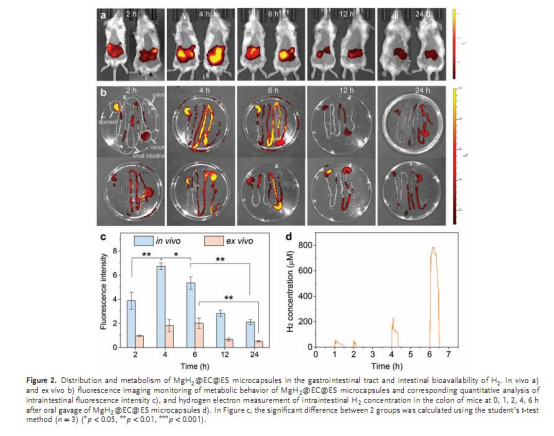
圖S8:ICP檢測表明微膠囊在腸道滯留6小時時達峰值(54.4%),24小時基本排出。
意義:證實了微膠囊的腸道靶向性和H?的持續釋放。
治療效果:
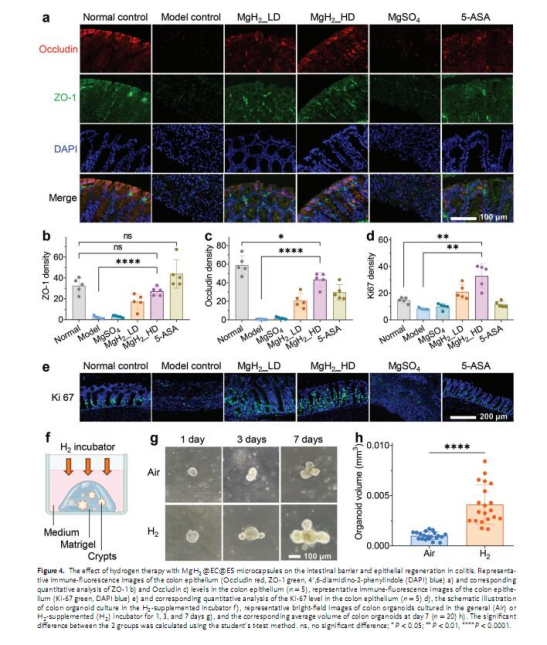
圖3b-h:高劑量微膠囊組(MgH2_HD)的結腸長度恢復(89.7%vs模型組)、DAI評分降低(與5-ASA相當),且組織病理學評分顯著優于5-ASA。
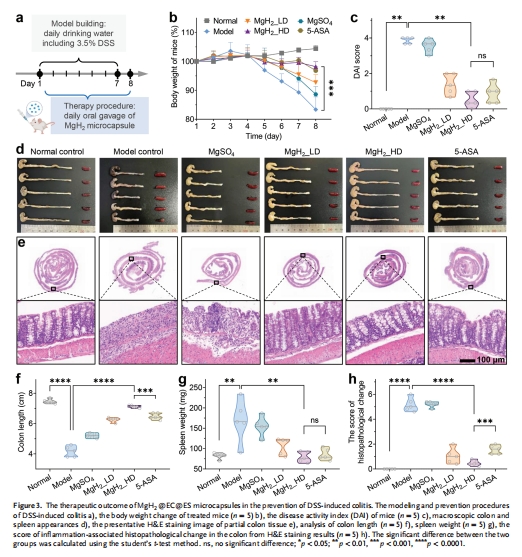
圖4a-e:免疫熒光顯示微膠囊組ZO-1和Occludin蛋白水平恢復,Ki-67陽性細胞增多,提示黏膜屏障修復和干細胞增殖。
意義:H?通過促進黏膜再生和抑制炎癥改善結腸炎。
線粒體機制:
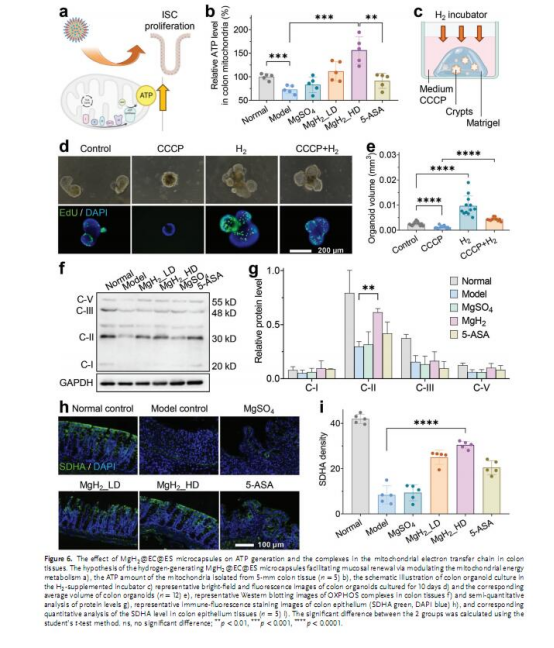
圖6b:高劑量微膠囊組結腸線粒體ATP水平高于正常組(1.5倍)。
圖6f-g:Western blot顯示微膠囊組線粒體復合物(II、IV、V)表達顯著恢復。
意義:H?保護線粒體電子傳遞鏈復合物免受氧化損傷,增強能量代謝。
結論
MgH2 EC ES微膠囊成功實現了腸道靶向控釋H?,產氫效率高且生物安全性好。
在小鼠結腸炎模型中,高劑量微膠囊通過恢復黏膜屏障、促進干細胞增殖和抑制炎癥,療效優于5-ASA。
機制創新:首次揭示H?通過保護線粒體復合物(如SDHA)減少電子泄漏,維持ATP合成,為氫療法的代謝調控機制提供了新視角。
Unisense電極數據的詳細解讀
實驗設計:
圖1i:體外模擬胃液(pH 1.2)和腸液(pH 7.0)中,使用Unisense氫電極實時監測H?濃度變化。
圖2d:通過結腸插管術,在口服微膠囊后不同時間點(0-6小時)直接測量結腸內溶解的H?濃度。
數據意義:
高靈敏度:Unisense電極可檢測低至0.01 ppm的H?,精準反映微膠囊在腸道的釋放動力學。
驗證靶向性:圖2d顯示H?在胃部幾乎無釋放(<0.2 ppm),而在結腸6小時達飽和(1.6 ppm),直接證明微膠囊的pH響應性。
支持治療機制:結腸H?濃度與ATP水平(圖6b)和線粒體復合物恢復(圖6f)正相關,表明H?的局部高濃度是療效的關鍵。
技術優勢:相比氣相色譜(GC),Unisense電極無需密封取樣,可實時監測活體腸道H?動態,為體內遞送研究提供了可靠工具。
以上總結覆蓋了論文的核心內容、方法創新、數據支撐及臨床轉化意義,尤其突出了Unisense電極在驗證遞送系統和療效機制中的關鍵作用。